【高校化学】ルシャトリエの原理をわかりやすく徹底解説!圧力や温度、体積との関係性は?

ルシャトリエの原理自体は何となく理解したけど、
希ガスを加えた場合や、体積一定で圧力を高くした場合、など
条件がややこしくなると、問題に答えられなくなる方も多いと思います。
今回はルシャトリエの原理について、様々な条件を例に徹底解説していきたいと思います。
入試でも頻出の範囲です。ぜひご覧になっていってください。
☆ ルシャトリエの原理とは
ルシャトリエの原理とは、
平衡状態にある反応において条件を変化させると、その条件が緩和する方向に平衡が移動することをいいます。
平衡状態の化学反応において、圧力や温度、分子の数などを変化させると平衡が移動して、新たな平衡が成立するということです。

きちんとした言葉で説明すると、わかりづらいのですが
圧力を下げれば、圧力が下がる方向に
温度を上げれば、温度が下がる方向に
要するに、加えた条件を打ち消す方向に平衡は移動するよ、っていうのがルシャトリエの原理になっています。
ここからは、温度や圧力、濃度など様々な条件を変化させたとき
ルシャトリエの原理により、平衡がどのように移動するかを確認していきたいと思います。
☆ 様々な条件を変えてみたら

上記の反応について、これからみていきたいと思います。
・ 濃度(物質の状態)を変化させた場合
反応物である窒素、水素を取り除く→反応物が増える方向に平衡が移動
よって、平衡は左に移動します。
生成物であるアンモニアを取り除く→生成物が増える方向に平衡が移動
よって、平衡は右に移動します。
・ 温度を変化させた場合
温度を上昇→温度が下がる方向に平衡が移動→吸熱反応側へ平衡が移動
よって、平衡は左に移動することとなります。
温度を減少→温度が上がる方向に平衡が移動→発熱反応側へ平衡が移動
よって、平衡は右に移動することになります。
・ 圧力を変化させた場合
圧力が上昇→圧力が下がる方向に平衡が移動→分子数が減少する方向へ平衡が移動
よって、平衡は右に移動します。

分子数と圧力の関係性について、ピンとこない人もいるかと思いますので解説していきます。
分子数が下がれば、圧力は減少します。
なぜかというと、圧力というのは気体の粒子などが容器などに壁に衝突するときに押す力のことをいいました。
分子数が少なくなれば、壁に衝突する回数が減りますので、圧力が小さくなります。

同じような原理で
圧力が減少→圧力が上がる方向に平衡が移動→分子数が上昇する方向へ平衡が移動
するので、例の化学反応においては、平衡は左に移動します。
☆ ルシャトリエの原理の応用
先ほどまでの条件が、ルシャトリエの原理の入試問題において出題される基本的な部分となっています。
ここからはレベルアップして、少し難しめの条件についても考えていきましょう。
・ 希ガスなどの化学反応に関係ない物質を体積一定で加えた場合
化学反応式に一切出てこない物質、今回だとアルゴンのようなものを体積一定で加えても
平衡は一切移動しません。
体積が一定、というのが大切なポイントとなっています。
なぜ平衡が移動しないのかというと、気体はそれぞれ独立して考えるからです。
今回の化学反応式に登場するアンモニアなどの気体は、たとえアルゴンなどの別の気体が加えられたとしても
影響を受けることなく存在することができるのです。

化学反応式に出てこない物質
すなわち関係のない物質を体積一定条件で加えたとしても、何も影響を受けません。
よって、平衡は移動しないということになります。
・ 希ガスなどの化学反応に関係ない物質を、圧力を一定で加えた場合
先ほど同じように、今度は圧力一定でアルゴンを加えたとしたら
圧力が増える方向、すなわち分子数が増える方向である左側に平衡が移動することとなります。
圧力が一定というのは、全圧が一定だということです。
全圧というのは、全ての気体の分圧の和です。
全圧を一定にしたままアルゴンを加えると、アルゴンの分圧を含めて全圧を保たないといけなくなるので
相対的に化学反応に関与する気体の圧力は減少します。
気体の圧力が減少したら、ルシャトリエの法則的に気体の圧力が増加する方向へと平衡が移動します。
よって、分子数が増加する左側へと平衡が移動するというわけです。

・ 触媒を加える
触媒を加えたとしても、平衡は移動しません。
触媒というのは、別の活性錯合体を作るための物質でした。
詳しくはこちらのページをご覧ください。(URL)
活性化エネルギーを下げるのが主な役割でしたね。
活性化エネルギーが下がれば、正反応の反応速度は増加します。
同時に、逆反応の反応速度も増加するのです。
正反応と逆反応、どちらの反応速度も増加すれば、プラスマイナスはゼロになります。
よって、平衡は移動しないこととなります。
☆ まとめ
ルシャトリエの原理とは
可逆反応において条件を変化させると、その条件変化を打ち消す方向へと平衡が移動することである。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】反応速度式はどのように決まる?温度・濃度・触媒との関係性をわかりやすく徹底解説!

反応速度と、温度や濃度、触媒との関係性。
温度が高くなると、反応速度が速くなるのはなんとなくわかるけど、原理はいまいちわからない
そんな化学学習者の方は多いはず。
今回は、反応速度と温度、濃度、触媒との関係性について、原理まで徹底解説していきたいと思います。
記述問題で出題されやすい範囲です。しっかりと自分の言葉で説明できるようにしていきましょう。
☆ 化学反応が起こる原理
化学反応は、
反応物が衝突を繰り返し、活性錯合体を作ることによって起こります。
詳しい原理はこちらのページで解説していますので、よかったらご覧ください。
(URL)
反応速度において大切なポイントとなるのは、化学反応を起こすためには
① 衝突を繰り返して
② 活性錯合体を作らなくてはいけない
ということです。
よって、衝突をする回数が増えれば増えるほど
活性錯合体が作りやすくなればなるほど
反応速度は増加します。
これらのことをふまえて、反応速度が決まる要因を確かめていこうと思います。
☆ 反応速度を決める要因は温度・濃度・触媒である
・ 反応速度と温度の関係性
温度が高ければ高いほど、反応速度は増加します。
なぜなら、温度が高くなると熱運動が激しくなり、活性化エネルギーを超えるエネルギーを持つ粒子の数が増えるからです。
温度が低いと、当然ですが、熱運動も小さくなります。

すると、このように活性化エネルギーを超える粒子の数も少なくなってしまうので、化学反応はなかなか進行しません。
温度が高くなれば、熱運動が激しくなります。
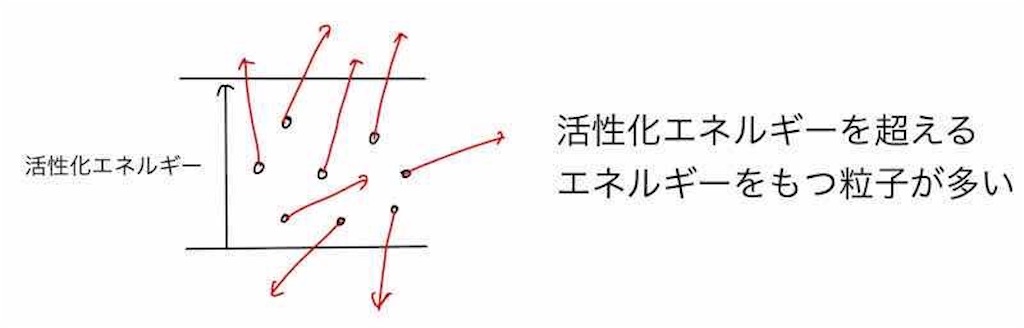
よって、このように活性化エネルギーを超える粒子の数が増加するため、化学反応が促進され、反応速度が増加します。
・ 反応速度と濃度の関係性
濃度が高ければ高いほど、反応速度は増加します。
なぜなら、単位体積あたりの粒子の数が多ければ多いほど、粒子が衝突する回数も増加するからです。

衝突する回数が増えれば、活性錯合体を作ることができる粒子の数も増えます。
濃度と反応速度の関係性はわかりやすいのではないかなと思います。
・ 反応速度と触媒の関係性
触媒を加えることによって、反応速度を高めることが可能です。
(場合によっては、遅めることも可能です。)
なぜかというと、触媒とは、本来作られやすいものとは別の活性錯合体を作るものだからです。
触媒によって、エネルギー順位の低い別の活性錯合体を作ることで、反応速度を高めることができます。
反対に、エネルギー順位の高い別の活性錯合体を作ることで、反応速度を遅めることができます。

触媒が、反応速度を理解する上で大切な要因だということはお分かりいただけると思います。
☆ 反応速度式
よって、反応速度をあらわす反応速度式は次のようにあらわすことができます。

反応速度式は、濃度の係数乗と反応速度が比例の関係であることから導かれた式です。
(濃度が大きいほど、反応速度が大きい、ということですね。)
また比例定数であるkは、触媒と温度によって変動する定数となっています。
多くの化学反応がこの反応速度式によって反応速度を求めることができますが、例外も数多くあるため
実際の反応速度は、実験によって計測しなくてはいけません。
☆ まとめ
反応速度は
① 温度、②濃度、③触媒
によって決定される。
このことから、反応速度式は

のようにあらわすことができる。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】活性化エネルギーとは一体なに?わかりやすく徹底解説!触媒との関係性も【反応速度】

活性化エネルギー。
名前はなんとなく聞いたことあるけど、一体それが何なのかをしっかりと理解している人はなかなかいないですよね。
今回は、活性化エネルギーとは一体何なのかを徹底解説していきたいと思います。
入試においては、語句問題であったり、反応速度と絡めた論述問題として出題されることが多い分野ですので、しっかりと定着させていきましょう。
☆ 活性化エネルギーとは
活性化エネルギーとは、
物質が化学反応を起こすために必要なエネルギーのことをいいます。
活性化エネルギーと同等のエネルギーを物質に加えてあげると、化学反応が起きるようになります。
ここからは、言葉の表面的な意味だけではなく、
そもそも化学反応はどのように起こるのかという観点から、活性化エネルギーについて深掘りしていきたいと思います。
☆ 化学反応が起こる原理
みなさん、化学反応がどのように起こるか知っていますか。
今から、水素とヨウ素がヨウ化水素になる反応を用いて、
化学を勉強する人が間違えやすい、誤った考え方を披露していきます。

・ 化学反応の原理について、間違った考え方
化学を勉強する人は、こういう誤った考え方をしがちです。

ヨウ素分子と水素分子はそれぞれ完璧にバラバラになって、ヨウ素原子と水素原子に
原子になった状態から、改めてヨウ素原子と水素原子が結合を作り、ヨウ化水素分子になるのではないか
…このような考え方はNGです。
なぜなら、化学反応を起こすとき、ヨウ素も水素も原子にはなりません。
・ 正しい化学反応の原理
ここからが正しい原理です。
ヨウ素と水素が化学反応を起こしたいとき、ヨウ素と水素は原子になるのではなく
活性錯合体というものを作って、そこからヨウ化水素分子になります。
物質が化学反応を起こしたいとき、分子は熱運動によって衝突を繰り返します。

分子は衝突を繰り返すことによって、原子になるのではなく
活性錯合体という、曖昧な状態の物質になります。

活性錯合体というのは、全ての結合が完全に切れてはないけど、くっついてもいない状態を指します。
上の図のように、ヨウ素原子同士、水素原子同士が完璧につながっているわけではないけど、切れてもいない
ヨウ素原子と水素原子も、完全に繋がってはいないけど、結合が切れているわけでもない
そのような、不安定な状態となっています。
物質は活性錯合体になった後、目指すべき生成物となります。

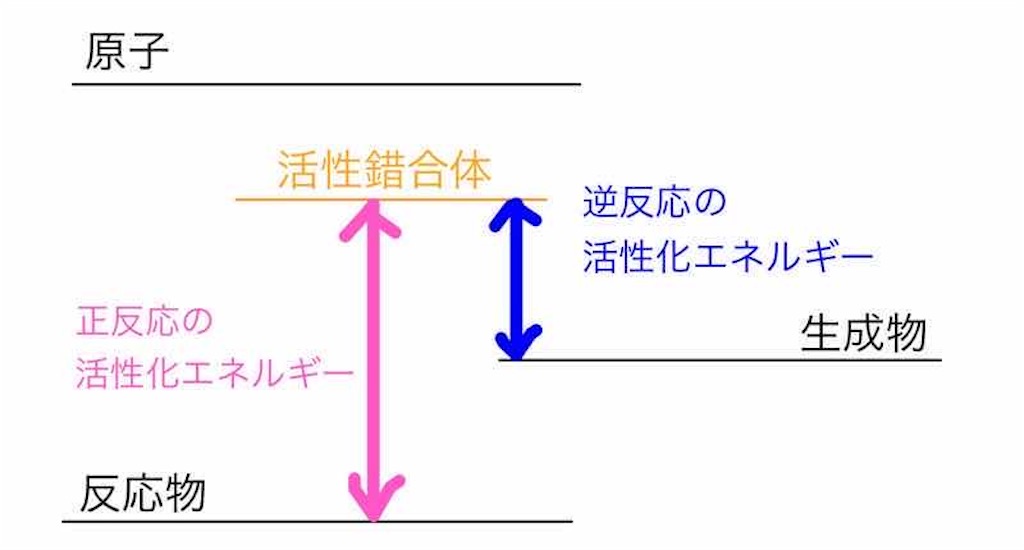
原子、分子、活性錯合体、それぞれのエネルギー順位をエネルギー図で表すとこのようになります。

基本的に、バラバラな状態のものほど、エネルギーを多く持っています。
よって、活性錯合体のエネルギー順位は、分子と原子の間です。
化学反応は、活性錯合体になることさえできれば、滞りなく進行します。
物質が活性錯合体になれさえすれば、化学反応は起こるのです。
物質が活性錯合体になるために必要なエネルギー、すなわち
物質が化学反応を起こすために必要なエネルギーを活性化エネルギーといいます。
図で表すと下の通りです。
☆ 活性化エネルギーと触媒の関係性
活性錯合体は一つの化学反応において、何種類か存在します。
その種類の中でも、1番作られやすい活性錯合体を経て、物質は化学反応を起こしているのです。
本来は作られにくい別の活性錯合体を作りやすくするものを、触媒といいます。
触媒は、化学反応を起こすスピードを速めるもの、というイメージがありますが
触媒は、本来は作られづらいエネルギー順位の低い活性錯合体を経由するようにすることによって、
反応速度を早めているわけです。

ちなみに、エネルギー順位が低い活性錯合体だけではなく、エネルギー順位が高い活性錯合体を作りやすくする触媒もあります。
そういった触媒を負触媒といって、病気の進行を遅らせる薬なんかに使われていたりします。
☆ まとめ
化学反応は、活性錯合体を経ておこっている。
活性錯合体になるために必要なエネルギーが、活性化エネルギーである。
触媒は、違う活性錯合体を作るように促すため、反応スピードを高める(時には遅める)ことができる。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【化学基礎】塩の加水分解をわかりやすく徹底解説!なぜ強酸と弱塩基の塩は酸性になるの?

弱酸と強塩基の塩は塩基性になる
強酸と弱塩基の塩は酸性になる
塩の液性は「強い方が勝つ」とこちらのページで学習しました。
ただ、その原理についてはしっかりと理解できていない化学学習者の方は多いのではないのでしょうか。
今回は
弱酸と強塩基の塩は塩基性になる、強酸と弱塩基の塩は酸性になる理由である
塩の加水分解の原理についてわかりやすく徹底解説していきたいと思います。
入試問題において、記述で問われる分野でもありますので、ぜひご覧になっていってください。
☆ 塩の加水分解とは
塩の加水分解とは、
塩が水分子と反応することによって、分解してしまうことをいいます。
ここでいう「塩」とは、酸と塩基の中和反応によって生成したものです。
塩はイオン性の物質ですので、水中においては電離して存在しています。
このことをしっかりと押さえて、塩の加水分解の原理に向き合っていきたいと思います。
☆ 復習、強酸・強塩基と弱酸・弱塩基の違いとは
そもそも強酸・強塩基と弱酸・弱塩基の違いは何だったでしょうか。
強酸・強塩基とは、
完全に電離して、H+あるいはOH -をたくさん放出するもの
弱酸・弱塩基とは、
ほぼ電離しておらず、H+あるいはOH -をあまり放出しないもの
となっています。
弱酸・弱塩基は電離しない、これを言い換えると
弱酸・弱塩基はイオンの状態であるよりも分子の状態でいた方が安定であるということを意味します。
よって、弱酸・弱塩基のイオンは
水中では分子に戻ろうとする反応を起こします。
☆ 塩の加水分解の原理
具体例を出しながら、塩の加水分解についてしっかり説明していきたいと思います。
・ 酢酸ナトリウムの塩の加水分解
酢酸ナトリウムは酢酸(弱酸)と水酸化ナトリウム(強塩基)によってできた塩です。
塩の液性は「強い方が勝つ」ので、酢酸ナトリウムは塩基性を示します。
その詳しい原理を見ていきたいと思います。
まず、酢酸ナトリウムは先ほども述べたように、酢酸と水酸化ナトリウムの中和反応によって生成します。
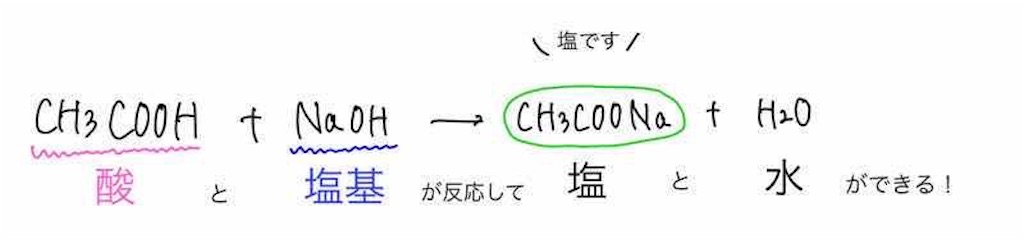
H+とOH −は出会って水に、酢酸イオンとナトリウムイオンが出会って酢酸ナトリウムになるわけです。
一般的な中和反応ですね。
しかし、酢酸ナトリウムは塩ですので、出会ったらすぐに電離をしてしまいます。

ここで考えて欲しいのですが、
ナトリウムイオンは強塩基由来のイオンなので、電離度が高い。すなわち、イオンの状態(=電離した状態)の方が安定です。
しかし、酢酸イオンは弱酸由来のイオンなので、電離度が低い。すなわちイオンの状態でいるのは不安定です。
なので、水分子からH+を受け取って、酢酸分子に戻ろうとするような反応を起こします。

酢酸イオンがH+を水分子が受け取ると、酢酸分子とOH−が生成します。
OH−が生成するので、酢酸ナトリウムの液性は塩基性になるのです。
塩の加水分解とは、言い換えると
弱酸・弱塩基が分子に戻ろうとして、水と反応する現象ともいえます。
・ 塩化アンモニウムの塩の加水分解
塩化アンモニウムは塩酸(強酸)とアンモニア(弱塩基)によってできた塩です。
塩の液性は「強い方が勝つ」ので、塩化アンモニウムは酸性を示します。
先ほどと同様に、その詳しい原理を見ていきたいと思います。
塩化アンモニウムは、塩酸とアンモニアの中和反応によって生成します。

アンモニアはブレンステッドローリーの塩基なので、電離してOH−を放出しているのではなく、水分子からH+を受け取ってアンモニウムイオンと水酸化物イオンになっていることには注意が必要です。
そして、一般的な中和反応と同じように、H+とOH −は出会って水に、塩化物イオンとアンモニウムイオンが出会って塩化アンモニウムの塩になるわけです。
しかし、塩化アンモニウムは塩ですので、出会ったらすぐに電離をしてしまいます。

先ほどの酢酸ナトリウムと流れは同じです。
塩化物イオンは強酸由来のイオンなので、電離度が高い。すなわち、イオンの状態(=電離した状態)の方が安定です。
しかし、アンモニウムイオンは弱塩基由来のイオンなので、電離度が低い。すなわちイオンの状態でいるのは不安定です。
なので、アンモニウムイオンは水分子にH+を渡して、アンモニア分子に戻ろうとするような反応を起こします。
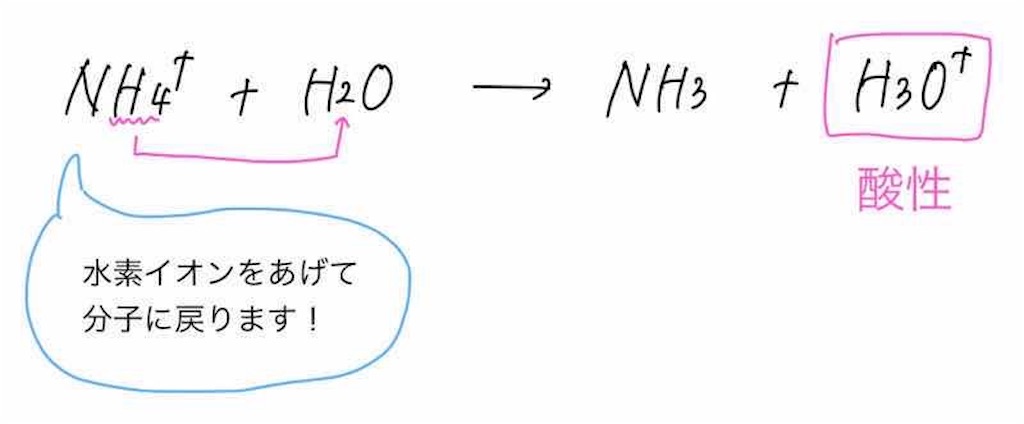
アンモニウム分子が水分子にH+を押し付けると、水分子はオキソニウムイオンに変化します。
酸の成分であるH+は厳密にいうと、オキソニウムイオンとして存在しているのでしたね。
よって、オキソニウムイオン(=酸の成分)が存在するのだから、塩化アンモニウムの液性は酸性を示します。
☆ まとめ
塩の加水分解とは、
弱酸・弱塩基が分子に戻ろうとする現象のことである。
弱酸+強塩基は塩の加水分解によって、OH−を放出するので塩基性を示す。
強酸+弱塩基は塩の加水分解によって、H3O+を放出するので酸性を示す。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【化学基礎】弱酸・弱塩基の遊離反応はなぜ起こる?原理をわかりやすく徹底解説!

弱酸の遊離反応や弱塩基の遊離反応。
無機化学や有機化学を理解するためにも、欠かせない知識となっています。
なんとなく化学反応式を作ることはできるけど、その原理はいまいち理解していない人も多いはず。
今回は、そんな弱酸・弱塩基の遊離反応を原理も含めて徹底解説していきたいと思います。
ぜひご覧になっていってください
☆ 強酸と弱酸、強塩基と弱塩基の違い
弱酸(弱塩基)の遊離反応を理解する上で欠かせない知識があります。
強酸(強塩基)と弱酸(弱塩基)の違いはなんなのかということです。
今回は強酸である塩酸HClと弱酸である酢酸CH3COOHを用いて説明していきたいと思います。
強酸とは完璧に電離をして、H+をたくさん放出するもののことをいいます。
強酸である塩酸は水溶液中では

の反応を起こし、電離度が1なので完璧に電離をしています。
電離度がほぼ1(=容易に電離できる)でH+をたくさん放出できるものが強酸なのです。
反対に弱酸である酢酸は、電離度が低いのでほぼ電離しておらず、H+をあまり出しません。

むしろ、電離してH+を放出する反応よりも、H+と酢酸イオンがくっついて分子になる反応が起きやすくなっています。
(上の画像だと、左向きの矢印の反応が優勢に起こっています。)
弱酸の電離反応というのは可逆反応であって、弱酸は分子でいたほうが安定なので、
H+と弱酸のイオンが出会うと分子に戻るような反応が起きます。
強酸(強塩基)と弱酸(弱塩基)の違いは
電離の反応が起きやすいか、分子に戻る反応が起きやすいかです。
弱酸(弱塩基)のイオンはH+(OH−)と出会うと、分子に戻る反応が進行します。
このことを頭にしっかりと入れながら、弱酸(弱塩基)の遊離反応に向き合っていきましょう。
☆ 弱酸(弱塩基)の遊離反応の原理
弱酸(弱塩基)の遊離反応とは、
弱酸(弱塩基)の塩にそれよりも強い酸(塩基)を入れると、弱酸(弱塩基)が生成する反応です。
例えば、酢酸ナトリウムに塩酸を入れると次のような反応が起きます。

酢酸ナトリウムの塩と塩酸の反応を用いて、弱酸(弱塩基)の遊離反応の原理を考えていきましょう。
まず、酢酸ナトリウムがビーカーの水に溶けている様子を想像してください。
酢酸ナトリウムは「塩」ですので、当然水の中では電離していますね。

このビーカーに、化学反応を起こすために塩酸を入れていきます。
塩酸も電解質ですので、水に入ったら電離してH+とCl -になります。

先ほどの弱酸とは何なのかで説明したように、
弱酸は電離度が小さい、むしろ分子に戻るような反応が優勢に働いているので、
弱酸のイオンとH+が出会うと、弱酸の分子に戻ってしまうのでした。
弱酸のイオンとH+が出会うと分子に戻ってしまうんです。
ビーカーの中には、弱酸のイオンである酢酸イオンCH3COO−とH+が存在します。
よって、酢酸イオンとH+は出会って、酢酸分子に戻ってしまいます。

あとはあまりものの、Na+とCl−がくっついて終わりです。
つまり、弱酸(弱塩基)の遊離反応とは、弱酸(弱塩基)のイオンがH+(OH−)と出会うと分子に戻ってしまうことを利用して起こる反応だといえます。
☆ まとめ
弱酸(弱塩基)の遊離反応とは、
弱酸(弱塩基)の塩にそれよりも強い酸(塩基)を入れると、弱酸(弱塩基)が生成する反応で、
これらは、
弱酸(弱塩基)のイオンとH+(OH−)が出会うと分子に戻ってしまう性質を利用している。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【化学基礎】アンモニアと二酸化炭素をみたら逆滴定!逆滴定の原理と計算を徹底解説

逆滴定、普通の中和滴定と何が違うのかいまいちよくわからないですよね。
苦手な人が多いのもこの分野です。
今回は、逆滴定の原理や計算方法について徹底解説していきたいと思います。
普通の中和滴定とは何が違うのか、しっかりと確認していきましょう。
☆ 逆滴定とは
ざっくりいってしまえば、逆滴定とは
気体の中和滴定、となっています。
逆滴定を用いる物質としては、アンモニアと二酸化炭素が有名です。
というか、アンモニアと二酸化炭素以外の逆滴定の問題を私はみたことがありません。
中和の範囲でアンモニアと二酸化炭素をみたら、逆滴定を疑いましょう。
また、なぜ気体(アンモニアと二酸化炭素)は逆滴定という少し変わった中和滴定をするのかというと
気体は普通の中和滴定をすることが困難だからです。
だって、気体を普通の中和滴定みたいにビュレットやコニカルビーカーに入れておくなんて無理ですよね。気体だから逃げちゃう。

よって、逆滴定とは
気体を大量の酸あるいは塩基に溶かして、余った部分を滴定する操作
となっております。
まだピンとこないと思います。次の章で詳しくみていきましょう。
☆ 逆滴定の詳しい原理
ここではアンモニアの逆滴定について考えていきましょう。
アンモニアは気体です。気体は普通の中和滴定は先ほどの理由からできません。よって、逆滴定を行います。
逆滴定の1ステップ目として、アンモニアは塩基ですので、大量の酸にアンモニアを溶かします。

なぜ大量の酸なのかというと、アンモニアにぴったりの酸なんて準備できないからです。
酸が少なすぎたら、アンモニアは全部溶けきれません。
アンモニアとちょうどの量の酸は、そもそもアンモニアのモル濃度がわかっていないのだから、用意できません。
よって、アンモニアを溶かすには十分量の酸(=つまり大量の酸)に溶かすしかないわけです。
大量の酸にアンモニアを溶かしきったら
アンモニアが溶けていない部分の酸を、アンモニアとは別の塩基で滴定します。

中和というのは必ず、
H+のmol = OH−のmol
の式が成立するのでしたね。
ここまでの、H+のmol = OH−のmolの関係性を図で表すとこのようになります。

これを中和の方程式で書き表すと、次のようになります。

求めたいもの(=今回はアンモニアのモル濃度)を文字式で置き、この方程式を解けば値を求めることができます。
このように、逆滴定を使うことによって、
周りくどい方法ではありますが、本来は滴定に向いていない気体の濃度を、中和滴定によって求めることができるのです。
☆ 逆滴定の練習問題
では、最後に練習問題を解いて、理解度を確認していきましょう。
(例題)
0.20 mol/Lの硫酸100 mLに、標準状態で56 mLのアンモニアを吸入させた。この混合溶液を中和するのに、0.1 mol/Lの水酸化ナトリウムは何mL必要か求めなさい。
(解説)

☆ まとめ
逆滴定とは、気体(主にアンモニアと二酸化炭素)の濃度を測るための中和滴定の方法である。
逆滴定は、まずは大量の酸あるいは塩基に気体を溶かして、気体が溶けていない余った部分を滴定する操作である。
逆滴定の計算は、通常の中和滴定と同じように
H+のmol = OH−のmol
の方程式を作れば良い。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
中和滴定をマスターする記事はこちら
【高校化学】中和滴定の実験の原理や計算問題を徹底解説!中和の計算式はここだけを気をつけて! - 化学の偏差値が10アップするブログ
【高校化学】中和滴定の実験の原理や計算問題を徹底解説!中和の計算式はここだけを気をつけて!

中和の計算式、意味はわかっていないけど、とりあえず公式に当てはめている人は多いですよね。
そして、公式で対応できない問題が来ると、混乱してしまうのもよくあることだと思います。
今回は中和滴定の実験の基本的な原理と計算問題を徹底解説していこうと思います。
中和滴定の計算に苦手意識がある方、ぜひみていってください。
☆ 中和滴定とは
中和滴定とは、酸と塩基の中和反応を用いて、(酸・塩基の)モル濃度を求める実験のことをいいます。
濃度がわからない酸あるいは塩基の濃度を、濃度がわかっている酸あるいは塩基で求めるわけです。
その原理については、後ほどお伝えします。
☆ 中和滴定の原理
中和滴定の実験や計算で押さえておかないといけない大切なポイントは、
酸(H+)のmol = 塩基(OH−)のmol
になったときに中和滴定は終わる、ということです。
同じように、中和滴定の計算では
酸(H+)のmol = 塩基(OH−)のmol
の式を作っていきます。
酸(H+)のmol = 塩基(OH−)のmol
本当に大切なので、しつこいくらい書きます、笑
中和滴定のざっくりとした原理としては、
濃度がわかっている酸あるいは塩基に指示薬を入れます。
指示薬というのは、中和点(H+=OH−になる点)になったら色が変化する試薬のことです。
濃度がわかっている酸あるいは塩基に、少しずつ濃度がわかっていない酸あるいは塩基を入れていきます。
すると、中和点になった瞬間に溶液の色が変わりますよね。
あとは、色が変わった瞬間について、求めたいものをxとおいて、
酸(H+)のmol = 塩基(OH−)のmol
の方程式を作れば、濃度がわかっていない酸あるいは塩基の濃度を求めることができる、ということになります。

細かい話は実験操作でお話ししたいと思います。
☆ 中和滴定の実験操作
・中和滴定の器具
まずは、中和滴定で使う4種の神器について確認しましょう。

この4つの器具の名前はしっかりと覚えてください。そのまま入試で出題されます。
器具でもう一つ押さえておかないといけないポイントとしては、

ホールピペット、ビュレットは共洗いが必要、コニカルビーカー、メスフラスコは共洗いが不要ということです。
めっちゃ大切です。
共洗いとは、その器具を使う前に、用いたい液体でその器具を洗う操作のことをいいます。
塩酸を使いたかったら、塩酸でその器具を洗っておく、ということですね。
なぜ、ホールピペットとビュレットは共洗いが必要で、その他が不要なのかというと、
各器具の使用用途にヒントがあります。
ホールピペット … 正確な濃度の溶液を、決まった体積で測り取るための道具
ビュレット … 正確な濃度の溶液を、決まった体積だけ、先端から別のものに入れる道具
コニカルビーカー … 中和滴定に用いられるビーカー
メスフラスコ … ある一定の濃度の溶液を作るための道具
ホールピペットとビュレットは正確な濃度の溶液を用いる道具です。
もしホールピペットとビュレットが水で内部が濡れていたら?
そのままこれらの道具を用いたら、溶液が水で薄まって、濃度が変わってしまいますよね。
濃度の変化を防ぐために、事前に用いる溶液で洗っておくのが共洗いの操作です。
よって、ホールピペットとビュレットは共洗いが必要、あとの2つは共洗いが不要となります。
・ 中和滴定の具体的な実験操作
実験操作を見ていきましょう。
今回は濃度がわかっていない市販のお酢(=酢酸)の濃度を中和滴定で求めたいと思います。
① (今回の場合は塩基の)正確な濃度の溶液をつくる
今回は酸(酢酸)の濃度が未知なので、正確に濃度がわかっている塩基が必要です。
そこで使う道具がメスフラスコです。
例えば、0.1 mol/Lの塩基を作りたいとしたら
0.1 molの塩基をメスフラスコに入れて、後入れで水を標線まで入れれば作れます。

ここで共通テストでよく出題されるのが、水は必ず後入れで入れるということ。
1L事前に用意した水に0.1 mol分の塩基を溶かすのはNGです。
なぜかというと、物質が溶けるときというのは体積が変化するから。
1L事前に用意した水に0.1 mol分の塩基を溶かしたら、溶かしたあとの溶液は1Lにはなりません。
少しだけ1Lを超えてしまいます。
体積が解けた後もちょうど1Lになるように、水は後から入れて体積を調節するのが正しい方法となっています。
② 濃度がわかっている方をビュレットに、濃度未知のものをコニカルビーカーに入れる
どちらも入れる前には共洗いが必要です。
コニカルビーカーの中には指示薬も入れましょう。
今回の場合は、コニカルビーカーに10 mL分のお酢を、ビュレットには①で作った正確な濃度の塩基を入れます。
③ 滴定開始!
ビュレットのコックを開け閉めしながら、少しずつコニカルビーカーに塩基を垂らしていきます。
すると、中和点になったとき、コニカルビーカーの中の溶液の色が変化します。
中和点までに入れた塩基の体積を、ビュレットの目盛りを読み取って記録しておきます。
以上で中和滴定の操作は終わりです。
中和滴定の流れを図で表すと下のようになります。

それでは計算に入っていきましょう。
☆ 中和滴定の計算
しつこいようですが、中和点では
酸(H+)のmol = 塩基(OH−)のmol
の関係性になっています。
なので、
酸(H+)のmol = 塩基(OH−)のmol
の方程式を作るのが、中和滴定の計算の基本です。
一応公式もありますが

公式で対応できないものが多くあるので、酸(H+)のmol = 塩基(OH−)のmolをベースに自分で方程式を作ることを強くお勧めします。
今回の実験結果は、このようになりました。

この結果を用いて、中和の方程式を作ると次のようになります。

どうでしょうか。いけそうですか?
中和のよくある練習問題を解いてみましょう。
☆ 中和の計算、練習問題
(1)0.4 mol/Lの硫酸 20 mLに中和に必要な1.0 mol/Lの水酸化ナトリウムは何mLか求めなさい。
(答え)

(2)水酸化カルシウム1.85 gに必要な2.0 mol/Lの酢酸は何mLか求めなさい。
(答え)

☆ まとめ
中和滴定とは
酸(H+)のmol = 塩基(OH−)のmol
の方程式を作ることによって、未知の酸あるいは塩基の濃度を求める実験
ビュレット、ホールピペットは共洗いが必要
コニカルビーカー、メスフラスコは共洗いが不要
である。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。