【高校化学】理想気体の状態方程式をわかりやすく徹底解説!公式の導出方法は?

公式はなんとなく覚えたけど、公式をうまく使いこなせない人は多いですよね。
気体は苦手な方がとても多い分野なのですが、
その理由は、気体を考える上での基本的な考え方ができていないからです。
今回は、理想気体の状態方程式の導出方法や、
気体を考える上での基礎となる体積などの定義をしっかり確認していこうと思います。
気体の範囲が苦手な方、ぜひ最後までご覧になっていってください。
☆ 気体に関する基本的な知識
こんなのわかってるよ!って人も多くいそうですが、
気体を理解する上で絶対に必要な基本的な知識をお伝えしていきます。
気体の圧力とは、
「粒子が壁にぶつかるときの力」をいいます。
同様に、気体の体積とは、
「気体が動いている範囲」のことをいいます。
つまり、気体の体積とは、容器の大きさのことです。
当たり前のようですが、とても大切なので、この感覚が掴めていない人はしっかりと確認してください。
☆ 理想気体の状態方程式の導出
ここからは、公式を導いていきたいと思います。
密閉された容器V(L)の気体の圧力について考えていきたいと思います。

ところで、みなさん。
容器内の圧力をあげるためには、どのようにすればいいと思いますか。
先ほども述べたように、気体の圧力とは、「粒子が壁を叩く力」です。
つまり、この質問は「粒子がたくさん壁にぶつかるようにするにはどうすればいいのか」というように言い換えることができます。
どのようにしたら、気体の圧力、すなわち壁にぶつかる回数を増やすことができるでしょうか。
壁にぶつかる回数を増やすには、
・単位体積あたりの粒子の個数を増やす。
・温度を高くする。
をすればいいです。
単純に中に入っている粒子の個数を増やせば、壁にぶつかる回数は増えますよね。
温度を高くすれば、熱運動も激しくなるので、粒子が壁を叩く回数も増加します。
よって、
圧力と(単位体積あたりの)粒子の個数
圧力と温度
は比例関係にあることになります。
これを式に表すと下のようになります。

この式をさらに変形すると、

となり、これが理想気体の状態方程式です。
比例定数Rを気体定数といい、R=8.3×10^3です。
気体の状態方程式は、圧力と単位体積あたりの粒子の数、温度が比例関係であることから導くことができます。
☆ まとめ
気体の圧力とは、粒子が壁を叩くときの力のこと。
気体の体積とは、粒子が動ける範囲のこと。

である。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【化学基礎】中和滴定の指示薬の種類と使い分けについて徹底解説!使える試薬と使えない試薬のその理由は?

指示薬の色の変化はなんとなく覚えたけど、
どういう時にどの指示薬を使うのか、その選定に迷う人は多いですよね。
今回は、
指示薬の種類とその使い分け方法について、徹底解説していきたいと思います。
ぜひ最後までご覧ください。
☆ 指示薬とは
指示薬とは、ざっくりというと
中和滴定において、中和点を見つけるための薬のことをいいます。
もうちょっと厳密な定義をいうと、
指示薬とは、pHによって色が変化する薬のことをいいます。
ここからもう少し詳しく、指示薬の定義とその利用について確認していきます。
☆ 指示薬の種類と変色域
・変色域
どの指示薬においても、変色域と呼ばれるものがあります。
変色域とは、
色が切り替わるタイミングのpHのことを指します。
指示薬を理解するためには、
①変色域、②色の変化、③どういう中和滴定に使える指示薬なのか
という3つのポイントが大切です。
この3つのポイントに着目しながら、覚えるべき指示薬について確認していきましょう。
・ 覚えるべき指示薬
みなさんが使い分けできて欲しい、特に大切な指示薬は2種類あります。
1つ目がメチルオレンジ
変色域がおおよそ3.0〜4.5。
変色域を挟んで、酸性側(赤)↔︎塩基性側(黄)に色が変化します。

2つ目がフェノールフタレイン
変色域がおおよそ8.0〜10.0。
変色域を挟んで、酸性(無色)↔︎塩基性側(赤)に色が変化します。

この2つは絶対に変色域、色の変化ともにしっかりと覚えてください。
他にも名前は知っておいた方がいい指示薬として、メチルレッドとBTB液がありますが
入試で深く問われることは少ないので、なんとなく知っている程度で良いでしょう。
☆ 指示薬の使い分けについて
指示薬の使い分けの問題で問われるのは、
メチルオレンジとフェノールフタレインの2つだけです。
どういった場合がフェノールフタレインで、どういった場合がメチルオレンジなのか、しっかりと判断できるようになりましょう。
まず、指示薬を使う目的は、中和滴定において
「中和点を見つけること」です。
どうやって指示薬が中和点を見つけるのかというと、
「色の変化」が起こることによって、中和点を見つけることができます。

指示薬が色が変わる瞬間は、変色域のpHになった瞬間です。
よって、変色域と中和点が一致しないと、中和点を見つけることはできません。
例えば、
酢酸(弱酸)と水酸化ナトリウム(強塩基)の中和点は強い方の性質が勝つので、塩基性です。
(詳しくはこちらの記事で取り上げています。
【化学基礎】塩の加水分解をわかりやすく徹底解説!なぜ強酸と弱塩基の塩は酸性になるの? - 化学の偏差値が10アップするブログ)
この中和滴定で変色域が酸性寄りのメチルオレンジを使っても、中和点を見つけることはできませんよね。
メチルオレンジの変色域(色が変わるタイミング)は酸性よりなので、中和点(塩基性)では色の変化がありません。
中和点が塩基性のものの中和点を見つけるためには、変色域が塩基性であるフェノールフタレインを使う必要があります。

中和滴定においては、
指示薬の変色域と中和点が一致する指示薬を選んであげる必要があります。
よって、
メチルオレンジは中和点が酸性のもの
フェノールフタレインは中和点が塩基性のもの
の中和滴定において使用することができます。
☆ 指示薬の使い分けの例題
最後に例題に取り組んで、理解度を確認していきたいと思います。
(問題)
① 硫酸と水酸化マグネシウムの中和滴定において、最も適当な指示薬を答えなさい。
② シュウ酸と水酸化カルシウムの中和滴定において、最も適当な指示薬を答えなさい。
(解答と解説)
① メチルオレンジ
硫酸(強酸)と水酸化マグネシウム(弱塩基)の中和滴定なので、中和点は酸性です。
よって、変色域が酸性側にあるメチルオレンジが適当です。
シュウ酸(弱酸)と水酸化カルシウム(強塩基)の中和滴定なので、中和点は塩基性です。
よって、変色域が塩基性側にあるフェノールフタレインが適当です。
☆ まとめ
指示薬とは、
PHによって色が変化する試薬で、主に中和点を見つけるために利用される。
メチルオレンジは酸性の中和点を持つとき
フェノールフタレインは塩基性の中和点を持つときの
中和滴定に利用される。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】緩衝液の原理を例を挙げて、簡単に解説!なぜpHが一定に保たれるの?

電離平衡からの、緩衝液。
初めて授業で習ったとき、難しくて意味がわからない!と頭を悩ませた人も多いはず。
今回は、そんな複雑でややこしい緩衝液の原理を
なるべくわかりやすく、簡潔に説明していこうと思います。
難しい範囲なだけあって、差がつきやすい範囲です。
ぜひご覧になっていってください。
☆ 緩衝液とは
緩衝液とは、
酸(水素イオン)や塩基(水酸化物イオン)を加えても、pHを一定に保つ性質を持つ溶液のことをいいます。
緩衝液は、
弱酸とその塩(例:酢酸と酢酸ナトリウムなど)
を混合することによって作ることができます。
入試問題には、わざわざその溶液が「緩衝液」であることを明言してくれないことも多いので、
この組み合わせを見たら、自分で「緩衝液だ!」と気づけるようになってください。
☆ 緩衝液の前提条件
なぜ酸や塩基を加えてもpHを変化しないのかという話の前に。
まずは緩衝液(弱酸とその塩の混合溶液)がどのような状態で存在しているのかを、しっかりと確認していこうと思います。
今回は、1番よく入試で見かける定番の緩衝液である
酢酸と酢酸ナトリウムを例に説明していきたいと思います。
ビーカーに酢酸と酢酸ナトリウムが入っているとします。(緩衝液)

上の図のように、酢酸は弱酸なので電離平衡状態、酢酸ナトリウムは塩なので完全に電離をしています。
塩(酢酸ナトリウム)が完全に電離している、というのが大切なポイントです。
酢酸は弱酸なので、水溶液中では電離平衡の状態として成り立っているのでした。
酢酸分子の一部が電離をして、酢酸イオンと水素イオンになっています。
ここでもう一つ大切なポイントです。
酢酸分子の電離平衡は、酢酸ナトリウムが電離して放出した酢酸イオンによって、
いつもよりも大きく、左向きに偏っている状態です。

言い換えると、酢酸ナトリウムが放出した酢酸イオンによる共通イオン効果によって、
電離平衡は左に偏っている。
すなわち、酢酸分子はほぼ電離していない状態だといえます。
よって、ビーカー内に存在している物質やイオンは、

酢酸ナトリウム由来の酢酸イオンとナトリウムイオン、酢酸分子のみとなります。
☆ 緩衝液のpHが一定に保たれる理由
・ 水素イオン(H+)を加えてもpHが変動しない理由
緩衝液の状態をしっかり理解していただいた上で、次は水素イオンを入れてもpHが変動しない理由についてみていこうと思います。
酢酸と酢酸ナトリウムの緩衝液に塩酸などの酸を入れると、どのようなことが起こるでしょうか。

酸を加えるということは、溶液中の水素イオンが増加します。
すると、ルシャトリエの法則により、水素イオンが減る方向へと平衡が移動するので、
酢酸の電離平衡が左へと傾きます。
よって、水素イオンを入れた分だけ、酢酸の電離平衡が左へと進行し、水素イオンが消費されますので、
pHは一定を保たれます。
・ 水酸化物イオン(OH−)を加えてもpHが変動しない理由
次は、塩基を加えた場合になぜpHが変動しないのかを見ていこうと思います。
先ほどと同じ酢酸と酢酸ナトリウムの緩衝液に、水酸化ナトリウム等の塩基を加えたら、どのような反応が起こるかおわかりいただけますか。
塩基と反応するのは、酸です。
酸と塩基はお互いに出会うと、中和反応を起こします。
先ほどの緩衝液のビーカーの中に、塩基と反応できる酸は酢酸しかありません。

塩基を加えた場合は、酸である酢酸分子と中和反応を起こします。

よって、塩基を加えても、加えた分だけ中和反応によって塩基が消費されますので
pHが変動しないということになります。
☆ 緩衝液の例題
最後に、緩衝液のよくあるタイプの例題を取り組んでいきたいと思います。
緩衝液の問題は独特な解法パターンとなっていますので、しっかりと確認していってください。
(例題)
1.0×10-2 molの酢酸と2.7×10-2 molの酢酸ナトリウムを混合して、1 Lの溶液を生成した。
このときの溶液のpHを求めなさい。ただし、酢酸の電離定数を2.7×10-5 とする。
(解説)
酢酸(弱酸)と酢酸ナトリウム(弱酸の塩)の組み合わせなので、緩衝液です。
解説はしたの画像で確認してください。

☆ まとめ
緩衝液とは
酸や塩基を加えてもpHを一定に保つことができる溶液である。
弱酸(弱塩基)とその塩の混合溶液は緩衝作用(緩衝液)を示す。
pHが変動しない理由は
酸(水素イオン)を加えたら、弱酸の電離平衡が分子になる方向へと傾き
塩基(水酸化物イオン)を加えたら、酸との中和反応が起きるため。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】鉄の精錬の原理についてわかりやすく徹底解説!一酸化炭素の役目やスラグとは

無機化学はとてつもなく覚えることが多く、工業的製法も種類が多くて嫌になってしまいますよね。
けれでも、企業や先人の人たちの英知が凝縮された工業的製法は、理論がわかれば楽しいと感じることも多い分野だと思います。
今回は工業的製法の中でも、「鉄の精錬」について
なるべくわかりやすく、徹底解説していきたいと思います。
鉄の工業的製法は、他の工業的製法よりかはシンプルです。
とっつきやすい範囲だと思いますので、ぜひご覧になっていってください。
☆ そもそも金属の精錬とは
鉄の精錬に入る前に。
そもそも「精錬」という言葉がピンときていない人がいると思いますので、解説していきます。
金属の精錬とは、
還元反応によって、化合物から金属の単体を生成する操作をいいます。
今回お話しする鉄は、汎用性の高い金属です。
磁石や建築物など、様々なものに使用されているので、大量生産する必要があります。
しかし、鉄というのは自然界では「鉄の単体」ではなく「鉄鉱石(Fe2O3)」という鉱山中の物質として存在しています。
鉄鉱石のFe原子の酸化数は「+3」、そこから単体のFe(酸化数0)にしていく操作
すなわち、還元反応によって鉄鉱石から鉄の状態にしていくことを鉄の精錬といいます。

☆ 鉄の精錬の一連の流れ
鉄の精錬の流れは2ステップです。
① 鉄鉱石(Fe2O3)を銑鉄(せんてつ)にする
② 銑鉄を鋼(こう)にする
の2段階です。
それそれ段階を踏んで、確認していきたいと思います。

・ 鉄鉱石を銑鉄にする過程
この過程では、
原料である鉄鉱石(Fe2O3)を、コークス(C)と石灰石(CaCO3)と一緒に溶鉱炉に入れて、
段階的に還元することで、銑鉄にしていきます。
ここで大切なのが、コークスと石灰石の役割です。
石灰石とコークスは、一酸化炭素を生成するために溶鉱炉内で加熱をします。
コークスは燃焼反応で、石灰石は熱分解反応によって、二酸化炭素を生成します。

ここでできた二酸化炭素を、未反応のコークスと一緒に加熱すると、一酸化炭素(CO)が生成します。

この一酸化炭素が、鉄鉱石を還元していく上でとても重要です。
なぜなら、一酸化炭素は不安定なため、相手の酸素を奪って安定な二酸化炭素になろうとする働きを持つからです。
言い換えると、相手を還元する力(=相手の酸素を奪う力)がとても強いのです。

還元性の強い一酸化炭素によって、鉄鉱石は段階的に溶鉱炉内で還元されます。

全体式は次のようになっています。

一酸化炭素による鉄鉱石の段階的な還元反応によって、
鉄鉱石は銑鉄という、不純物として炭素Cを含んだ柔らかい鉄の単体になります。
・ 銑鉄を鋼にする過程
銑鉄は炭素を含んでいるので、脆くて柔らかいです。
とても壊れやすいので、実用性はあまりありません。
よって、不純物である炭素を取り除いて、純度が高くて実用性が高いものにしていく必要があります。
どうやって、不純物である炭素を取り除いていくのかというと、
融解した銑鉄に酸素を吹き込むことによって、それを実現しています。
銑鉄に酸素を吹き込むと、

の炭素の燃焼反応が起こり、炭素は二酸化炭素へと変化します。
二酸化炭素は気体なので、熱することによって吹き飛びます。
これによって、銑鉄は炭素が取り除かれ
純度の高い鋼(こう)になります。
鋼は純度が高く、粘り気があって硬いです。
建築物などにも使われており、実用可能な鉄の単体となっています。
(多少のCは含みます。)
☆ スラグとは
スラグという単語は、鉄の精錬の一段階目に関係しています。
鉄鉱石の主成分はFe2O3ですが、
実は鉄鉱石にはFe2O3だけではなく、SiO2やAl2O3が不純物として存在しています。
CaSiO3やCa(AlO2)2に変化します。
この、CaSiO3やCa(AlO2)2のことをスラグといいます。
副生成物含めて、すべての材料が無駄なく活用されているのが、鉄の精錬の素晴らしいところだと思います。
☆ まとめ
鉄の精錬は、鉄鉱石を還元して鉄の単体を作る作業のこと。
鉄鉱石の還元には、一酸化炭素の還元力を利用している。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】アルケンの性質(π結合・付加反応・マルコフニコフ則)についてわかりやすく徹底解説!

アルケンといえば、付加反応が有名ですよね。
では、アルケンがなぜ付加反応が起こりやすいのかは説明できますか?
今回はアルケンの立体的構造から、アルケンの付加反応について徹底的に解説していきたいと思います。
アルケンの立体構造についてしっかりと理解していると、ベンゼンなどの反応性についても理解しやすくなります。
(アルケンの立体構造について知らない人も多いですが、国公立大学の入試だと記述で出題されます。)
また、マルコフニコフ則についてもわかりやすく説明していますので、ぜひみていってください。
☆ アルケンとは
アルケンとは、
一般式CnH2nで表すことができる、二重結合を持っている有機化合物の総称をいいます。
アルケンは二重結合のうちの1本が切れて、切れた部分に物質がくっつく反応である付加反応が起こりやすいです。
なぜ付加反応が起こりやすいのかは、アルケンが持つ二重結合の立体構造を理解すれば、説明できるようになります。
☆ 二重結合の立体構造
まずは名称の確認です。
炭素どうしの間にある二重結合において、
1本目の結合をσ(シグマ)結合、2本目の結合のことをπ結合といいます。

アルケンにおいては、π結合の立体構造を理解することが大切となっています。
二重結合の1本目の結合であるσ結合は、平面上に位置しています。

では、π結合は立体的にはどのように位置しているのでしょうか。
結合というのは、電子からできていますよね。
お互いに不対電子を出しあっている結合が共有結合です。
σ結合もπ結合もマイナスの電荷を持つ電子からなっているので、
互いに反発しあって、なるべく遠くに位置しようとする力が働きます。
平面上にあるσ結合からなるべく遠くへ位置しようとした結果、π結合は立体的に飛び出しているような配置となります。

π結合は立体的に飛び出ている、これは
他の物質から攻撃をされやすいことを意味します。
よって、アルケンというのはπ結合が攻撃されるような反応が起きやすいです。
☆ アルケンの代表的な反応・付加反応
付加反応とは、π結合が切れて、余った結合の部分に他の原子がくっつく反応をいいます。

立体的に飛び出ているπ結合が攻撃された結果、π結合が切れて、付加反応が起こるわけです。
付加反応とは、π結合の立体的な配置があるからこそ起こる反応といえます。
よくある付加反応の例としては、
・ ハロゲン化水素
・ ハロゲン分子 ※1
・ 水分子 ※2
・ 水素分子
などがあげられます。どれも入試に頻出ですので、しっかりと確認してください。
特に注意してほしい反応としては※1の1種である臭素の付加反応です。
アルケンに臭素が付加反応すると、溶液が赤褐色→無色に変化します。
臭素はもともと赤褐色の色味を持つ物質です。アルケンに臭素が付加したことにより、臭素の色味がなくなって無色に変化したわけです。
この反応は、アルケンの検出反応として、入試に頻出となっています。
問題文中の文章に「臭素を添加したところ、溶液の色が無色になった」という記載があれば、それはアルケンであることを意味しますので
構造決定の問題に役立ててください。

※2のマルコフニコフ則については次の段落で詳しく解説します
☆ マルコフニコフ則とは
アルケンへの水の付加反応やハロゲン化水素の付加反応については、マルコフニコフ則について考える必要があります。
マルコフニコフ則を簡単にいうと、
水素をたくさん持っている炭素に水素がくっつく!
という法則となっています。
例えば、プロピレンの付加反応について考えみたいと思います。

プロピレンの炭素に番号を振りました。
①番炭素の方が、②番炭素よりも水素原子を多く持っていますよね。
よって、水素は①番炭素にくっつき、②番炭素にはヒドロキシ基(−OH)であったり、ハロゲンが付加するこということになります。
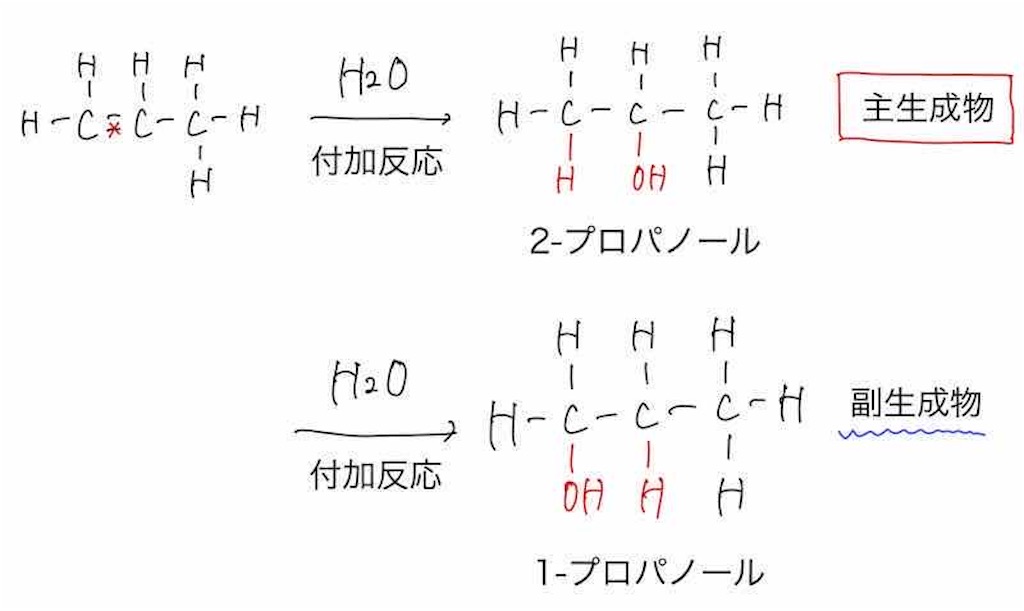
なので、上の図の水の場合で言うと、2−プロパノールが主生物で1−プロパノールは副生成物となります。
☆ まとめ
アルケンとは、二重結合を有する物質である。
アルケンの持つπ結合は、立体的に飛び出したような配置となっている。
よって、アルケンは付加反応が起こりやすい。
マルコフニコフ則とは、「水をたくさん持っている炭素に水素がつく」という法則である。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【無機化学】アンモニアの工業的製法であるハーバーボッシュ法をわかりやすく徹底解説!

最もよく耳にする化学物質の一つとして、アンモニアという物質があります。
アンモニアは炭酸ナトリウムなどの工業的製法の原料にもなっており、大量生産をしなくてはいけない物質となっています。
今回は、そんなアンモニアを工業的に生成する方法である
ハーバー・ボッシュ法について、わかりやすく徹底解説していきたいと思います。
記述問題で問われやすい分野です。
ルシャトリエの原理を絡めながら、しっかりと原理と向き合っていきましょう。
☆ ハーバーボッシュ法とは
ハーバーボッシュ法とは、ハーバーさんとボッシュさんが2人で開発した
窒素と水素の単体を直接化合して、アンモニアを作る方法となっています。
ハーバーボッシュ法は今日においても、アンモニアの工業的製法として活躍しています。
ハーバーボッシュ法で確認しなくてはいけない点は
「いかにして安定な窒素と水素を直接化合したのか」というものです。
特に窒素分子は三重結合でしっかりとつながっており、少しのエネルギーではびくともしません。
安定な窒素をどうにかしてアンモニアまで持っていくための条件について、詳細を確認していきましょう。

☆ ハーバーボッシュ法の詳細な条件
ハーバーボッシュ法の化学反応式は次のようになっています。

触媒は四酸化三鉄です。語句問題で問われることがありますので、触媒の物質名はしっかりと覚えておきましょう。
・ 圧力の条件について
安定な窒素を反応させてアンモニアにするためには、どうにかして平衡をアンモニアが生成する方向、すなわち右向きへと持っていかないといけません。
ハーバーボッシュ法の場合、高圧にすれば平衡は右へと移動します。

ハーバーボッシュ法の化学反応式において、反応物の分子の数は4分子、生成物の分子の数は2分子となっています。
高圧にすれば、平衡は圧力を下げる方向へと反応が進行します。
すなわち、分子数が下がる方向です。
よって、高圧にすることによって、分子数が下がる方向であるアンモニアが生成する反応を促進することができるのです。
・ 温度の条件について
先にお伝えしますが、温度の条件についてはルシャトリエの原理とは反する条件になっています。
ハーバーボッシュ法では、高温にて化学反応を進行させます。
本来、ハーバーボッシュ法は発熱反応なので、
低温にした方が、ルシャトリエの原理的には温度が上昇する方向、すなわちアンモニアを生成する方向へと反応が進みます。
しかし、低温だと反応速度が遅くなってしまい、平衡状態に到達するのにとてつもない時間がかかってしまうため
ハーバーボッシュ法においては、反応速度を高めることを重視して、高温にて化学反応を起こしています。

間違えやすい部分でありますので、しっかりと確認しておきましょう。
☆ まとめ
ハーバー・ボッシュ法とは、
本来は反応しづらい安定な窒素分子と水素分子を直接化合させて、アンモニアを生成する工業的製法である。
ハーバー・ボッシュ法では、高温・高圧にて化学反応を進行させる。
(ルシャトリエの原理的には低温が適しているが、反応速度を優先したため高温で反応させている。)
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】化学平衡の基本の原理をわかりやすく徹底解説!質量作用の法則の導出方法など

化学平衡。化学を勉強している人の中で、最もつまずく人が多い範囲となっています。
計算がややこしくて、いまいちよくわからないという人も多いはず。
今回は、そんな化学平衡の基本の原理を徹底解説していきたいと思います。
化学平衡の原理は、そんな難しいものではありません。
原理をしっかり押さえて、平衡の分野が得点源になるように頑張りましょう。
☆ 可逆反応と不可逆反応
化学平衡の原理を学ぶ前に、押さえておくべき単語の意味を確認していきたいと思います。

このような反応において、
反応物側から生成物側へと反応が進行する反応、すなわち右むきの矢印の反応のことを正反応
生成物側から反応物側へと反応が進行する反応、すなわち左むきの矢印の反応のことを逆反応といいます。
また、
正反応、逆反応ともに起こりうる化学反応のことを可逆反応
正反応のみしか起こり得ない反応のことを不可逆反応といいます。
今からお伝えする話は、入試で深く聞かれることはないので、興味がある方以外は飛ばしても構いません。
みなさん、どのような反応が可逆反応になって、どのような反応が不可逆反応になるかはご存知でしょうか。
可逆反応になりやすい化学反応とは、下のようなエネルギー準位をもつものです。

正反応の活性化エネルギー、逆反応の活性化エネルギーの大きさを比較すると、どちらも大差がありません。
正反応と逆反応を起こす労力はどちらも同じくらいになっています。
このような化学反応は、可逆反応になりやすいです。
一方、このように、

正反応と逆反応の活性化エネルギーを比較すると、逆反応の活性化エネルギーが著しく大きくなってしまう場合は
逆反応を起こすのにエネルギーが膨大に必要になってしまうので、逆反応が起こりにくい
すなわち、不可逆反応になりやすい化学反応といえます。
☆ 平衡状態とは
平衡状態とは、
正反応と逆反応の反応速度が同じため、一見反応が停止したように見える状態のことを指します。
ここで大切なのは、止まったように見えるだけで、実際に反応が停止しているわけではないということです。
正反応も逆反応も同じスピードだから、何も起こっていないように見えるけど
絶えず化学反応は起こり続けているということを、しっかりと頭に入れておいてください。
☆ 質量作用の法則(化学平衡の法則)の導出
ここから、みなさんがこれから計算でたくさん向き合うことになる
質量作用の法則(化学平衡の法則)という公式の導出をしていこうと思います。

こちらの化学反応における平衡状態について、考えていきます。
まず、平衡状態とは先ほども述べたように、正反応と逆反応の反応速度が同じであるため、見かけ上反応が停止したように見える状態をいいました。
反応速度の分野で学習したように、正反応の反応速度をV1、逆反応の反応速度をV2、正反応と逆反応の速度定数をそれぞれK1、K2とすると
V1とV 2は

このようにあらわすことができます。
平衡状態では、V1=V2ですので

が成立します。さらにこの式を整理していくと

となります。K1とK2はいずれも定数です。よって、K1/K2をひとまとめの定数Kとおくと

というようにあらわすことができます。
このときの定数Kを平衡定数といい、定数Kが上の式のようにあらわすことができることを質量作用の法則(あるいは化学平衡の法則)といいます。
まとめると、

です。ざっくりと左辺分の右辺が平衡定数だということを押さえておきましょう。(ただし、係数乗を忘れずに!)
また、平衡定数Kは先ほどの導出でわかるように、反応速度の定数であるK2/K1を置き換えたものです。
反応速度の定数であるK1、K2は温度により変化するものでした。
よって、平衡定数も同じように温度ごとに一定の値をとります。(言い換えれば温度によって平衡定数は変化します。)
☆ まとめ

平衡定数は左辺分の右辺!
平衡定数は温度ごとに一定の値である。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。