【高校化学】蒸気圧降下と沸点上昇の原理をわかりやすく徹底解説!電解質と非電解質との違いは?

沸点上昇の計算問題、原理はよくわからないけど、とりあえず公式を丸暗記して乗り切ってる方は多いのではないでしょうか。
電解質のときは、電解して生成したイオンの分子の数だけ掛け算しているけど、それを行う意味をわかっていない方も多いと思います。
今回は蒸気圧降下と沸点上昇の原理について、徹底解説していきたいと思います。
原理から公式の意味をしっかり理解して、ライバルと差を付けちゃいましょう。
☆ 蒸気圧降下と沸点上昇とは
蒸気圧降下とは、純溶媒よりも希薄溶液の方が蒸気圧が小さくなる現象のことをいいます。
何も溶けていない溶液よりも、何かが溶けている溶液の方が蒸気圧が小さくなるわけです。
沸点上昇とは、蒸気圧降下が起こった結果、沸点が上昇する現象をいいます。
イメージとしては、蒸気圧降下が起こった結果として、たまたま沸点が下がる現象が確認された、という感じです。
なので、沸点上昇と蒸気圧降下はお互いを理解する上で切り離して説明することができないものとなっています。
よくこの2つの現象を別々に切り離して理解しようとする方がいますが、原理を考える上では、この2つはセットで扱うようにしましょう。
どちらも希薄溶液の代表的な性質の1種です。
※ 希薄溶液とは、濃度が薄い溶液のことです。
☆ 蒸気圧降下の原理
なぜ、純粋な溶媒(純溶媒)よりも希薄溶液の方が蒸気圧が小さくなるのかをみていこうと思います。
蒸気圧とは、気液平衡の状態(気体と液体)における、気体の圧力のことを言いました。
例えば、ペットボトルに入っている水は液体のみで存在しているわけじゃなく、一部は水蒸気(気体)の状態として存在しています。
このときの水蒸気の圧力が蒸気圧です。
純溶媒では、液体の表面にある溶媒粒子が熱運動によって気相に飛び出して、気体となっています。
気体となっている溶媒分子による圧力が、蒸気圧です。
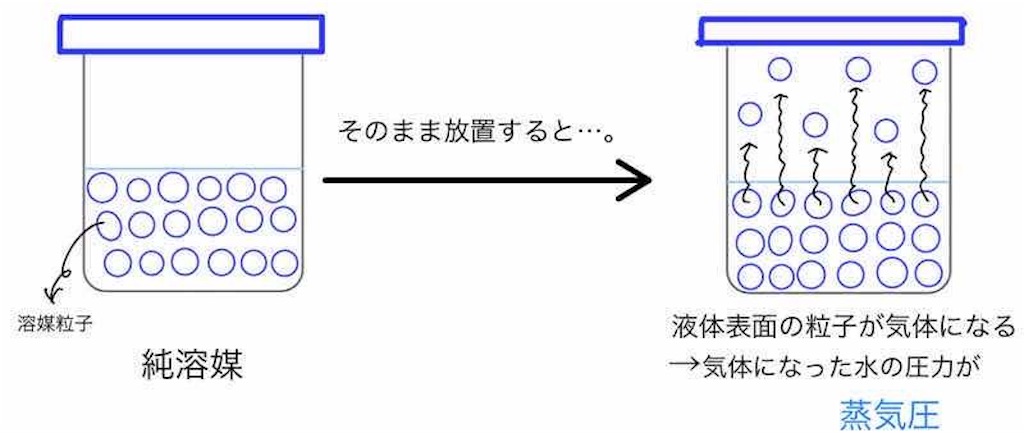
純溶媒に溶質を溶かして希薄溶液とすると、蒸気圧はどうなるでしょうか。
当然ですが、溶質が溶けている分、液体の表面にある溶媒分子の数は減少します。

その分、気相に飛び出す溶媒分子の数も減少するので、蒸気圧は減少しますね。

これが蒸気圧降下です。
つまり、蒸気圧降下とは、溶質粒子に邪魔されることによって、気相に飛び出す溶媒分子が減った結果
蒸気圧が小さくなる現象をいいます。
溶媒に対する溶質粒子の数が多ければ多いほど、その分気相に飛び出す溶媒粒子が減少するので
蒸気圧は小さくなります。
☆ 沸点上昇の原理
蒸気圧が降下をすると沸点は上昇します。
状態図を見てみましょう。

上の図のように、圧力と温度における物質の状態を表した図を状態図といいます。
状態図の液体と気体の境界線部分をピックアップしたものが、蒸気圧曲線です。
純溶媒に溶質を入れて、蒸気圧降下が起こったら、蒸気圧曲線はどのようになるでしょうか。

蒸気圧曲線が下にずれ込むのがわかりますね。
沸点というのは、標準状態(1.0×105 Pa)における蒸気圧曲線との交点の温度をいいます。
蒸気圧曲線が下にずれると、沸点は上昇します。


蒸気圧降下が起こり、蒸気圧曲線が下にずれた結果、沸点がグラフ上で上昇する現象が沸点上昇です。
沸点上昇は蒸気圧曲線がないと説明できないものとなっていますので、グラフとセットで頭に入れておきましょう。
☆ 沸点上昇の公式
蒸気圧降下がおこった結果、蒸気圧のグラフが下にずれて、沸点が上昇するのは理解できたと思います。
つまり、蒸気圧降下が大きければ大きいほど、沸点上昇度も大きくなるわけです。
そして、溶媒に対する溶質粒子の割合(邪魔をする粒子の割合)が大きいほど、蒸気圧降下も大きくなります。
溶媒に対する溶質粒子の割合が大きいほど、沸点上昇も大きくなるわけです。
よって、沸点上昇を求める公式は次のようになっています。

質量モル濃度mは、溶媒(kg)に対する溶質のmolを表したものです。
溶媒に対して、どれだけ溶質粒子(=蒸気圧になるのを邪魔する粒子)があるのかを表しています。
この公式は、溶媒に対する溶質粒子の数(=蒸気圧になるのを邪魔する粒子)と沸点上昇は比例の関係であるという意味となっています。
kは比例定数で、kは溶媒によって固定の値をとります。
☆ 沸点上昇と電解質
電解質は溶媒に溶けると電離して、イオンになる物質です。
例えば、塩化ナトリウムや硫酸ナトリウムがイオン性の電解質です。

硫酸ナトリウムは水に溶けると、1分子から3分子分のイオンに電離していて
塩化ナトリウムは水に溶けると、1分子から2分子分のイオンに電離するわけですね。

しつこいようですが、
邪魔する溶質粒子の数が多いほど、沸点上昇度は高くなります。
電解質の場合、電離して生成したイオンの分子の数だけ、邪魔する粒子が増えるのですから、
沸点上昇の公式に、生成したイオンの分子の数だけ掛け算する必要があります。

☆ まとめ
蒸気圧降下とは
溶質粒子によって溶媒粒子が蒸気圧になるのを邪魔されて、蒸気圧が小さくなる現象
沸点上昇とは
蒸気圧降下がおこった結果、蒸気圧曲線が下にずれて、沸点が上昇する現象
である。
沸点上昇の公式は

電解質の場合は、電離して生成したイオンの数だけ、公式に掛け算をしなくてはいけない。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。