【高校化学】水酸化鉄(Ⅲ)のコロイド溶液の透析実験について解説!化学反応式や原理など

入試問題でよく見る、水酸化鉄の透析の実験。
なんとなく丸暗記でカバーしていますが、その実験原理を理解している人は少ないですよね。
今回は水酸化鉄(Ⅲ)のコロイド溶液の透析実験について、原理などをわかりやすく解説していきたいと思います。
入試に出題される部分を絞って解説していきますので、ぜひ最後までご覧ください。
⭐︎ 水酸化鉄(Ⅲ)のコロイド溶液の作り方
水酸化鉄(Ⅲ)は高校化学において、最も有名なコロイド粒子の一つです。
水酸化鉄(Ⅲ)の製法は、しっかりと入試において暗記しておく必要があります。
水酸化鉄(Ⅲ)生成の化学反応式は以下の通りです。
FeCl3 + 3 H2O → Fe(OH)3 + 3 HCl
これをしっかり確認した上で、実験の流れについて順番にみていきましょう。
⭐︎ 水酸化鉄(Ⅲ)の透析実験
透析とは、粒子の大きさの違いを利用して、半透膜で不純物を取り除くことをいいます。
コロイドは一般的なイオンなどよりも大きい粒子ですので、半透膜を通過することができません。
これを踏まえて、水酸化鉄(Ⅲ)の実験の流れを確認していきましょう。
① ビーカーで水酸化鉄(Ⅲ)のコロイド粒子を作る
先述の化学反応式で、水酸化鉄(Ⅲ)のコロイド粒子を作ります。
このとき化学反応が終わったビーカーの中には、(過不足がないと仮定すると)Fe(OH)3のコロイド粒子と、電離した水素イオンと塩化物イオンが存在している状態になっています。

② 反応が終了したビーカーを、水に浸した半透膜の中に注ぐ
①で生成したビーカーの中身を、下の図のようになっているビーカーの半透膜の中に全て注ぎ込みます。

このまましばらく放置しておくと、
Fe(OH)3はコロイド粒子なので、半透膜を通過できず、膜の中に留まっています。
電離している水素イオンと塩化物イオンは半透膜を通過できるので、この2つのイオンは膜の外に出ていきます。
しばらく放置した後の実験装置は下の図のようになります。

これが水酸化鉄(Ⅲ)の透析の大まかな流れです。
⭐︎ 実験のポイント
ここで押さえておくべきポイントは2つです。
ポイント① 膜の外に水素イオンがある=膜の外は酸性である
膜の外は水素イオンがありますので、酸性になります。
メチルオレンジやpH試験紙、リトマス紙などで膜の外の液性を調べる記述が入試ではみられます。
各種試験紙の色はしっかりと答えられるようにしておきましょう。
ポイント② 膜の外に塩化物イオンがある=硝酸銀で白色沈澱ができる
塩化物イオンが膜の外にあるので、硝酸銀を膜の外に加えれば、AgClの白色沈殿が生成します。
沈澱の色や沈澱の化学式は問われやすいです。
そのほかにも、膜の外が酸性であることからpHを計算する問題なども出題されますので、しっかりと対応できるようにしておきましょう。
⭐︎ まとめ
水酸化鉄(Ⅲ)生成の化学反応式は以下のとおり。
FeCl3 + 3 H2O → Fe(OH)3 + 3 HCl
水酸化鉄(Ⅲ)を生成し、ビーカーの中身を透析すると、
水酸化鉄(Ⅲ)はコロイド粒子なので半透膜の内側に、水素イオンと塩化物イオンが半透膜の外に存在するようになる。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】親水コロイドと疎水コロイドとは。なぜ塩析と凝析が起こるのか簡単に説明してみた。価数の話も

塩析と凝析。
どっちが親水コロイドでどっちが疎水コロイドなのか、多量なのか少量なのか、頭の中でごちゃ混ぜになってしまいますよね。
今回は塩析と凝析について、原理をわかりやすく解説していきたいと思います。
原理がわかれば考えてわかるようになると思いますので、ぜひ最後までご覧ください。
⭐︎ 塩析とは
塩析とは、親水コロイドに多量の電解質を加えることで、コロイド粒子を析出させることをいいます。
「親水コロイド」と「多量」というのがポイントです。
親水コロイドは、水に溶けやすいコロイド粒子のことをいいます。
もっというと、親水コロイドは極性が強いので水分子と水和して存在しています。
水分子とくっついている=溶けているという状態です。

この溶けている状態から、析出(=固体が出てくる)状態にするには、水分子をコロイド粒子から剥がしてあげる必要があります。
親水コロイドが溶けている(=水がくっついている)状態に少し電解質を加えても、コロイド粒子が水分子を引っ張る力の方が強いので、コロイド粒子から水分子は離れません。
電解質を大量に加えると、電解質が水分子を引っ張る力の方がコロイドが水分子を引っ張る力より強くなり、コロイド粒子から水分子が離れます。
水分子からコロイド粒子が離れる=溶けている状態じゃなくなった、なので、コロイド粒子の結晶が析出するのです。

これが塩析の原理となっています。
⭐︎ 凝析とは
凝析とは、疎水コロイドに少量の電解質を加えることでコロイド粒子が析出することをいいます。
「疎水コロイド」と「少量」というのがポイントです。
疎水コロイドは、水には溶けづらいコロイド粒子のことをいいます。
疎水コロイドの身近な例としては絵の具(を水に溶かしたもの)などがあります。
絵の具は一見水に溶けているように見えて、親水コロイドかなと思いますよね。
絵の具が水に溶けているように見えるのは、絵の具のコロイド粒子が分散していて、一見溶けているように見えているだけです。
コロイド粒子は正または負の電荷を持っているので、同じ符号を持った疎水コロイド粒子同士が反発し、分散している状態で存在します。

この分散している疎水コロイドがまとまって集合すれば、疎水コロイドは析出するのです。
疎水コロイドに電解質を少し加えると、持っていた電荷が中和され、分散していたコロイド粒子が集合していきます。

これが少量の電解質で疎水コロイドが集合して析出する、凝析という現象になっています。
⭐︎ 1番効率よく凝析をするためには
凝析は、コロイド粒子と異符号の電荷を加えることでコロイド粒子の電荷が弱まり、集合して析出する現象でした。
当然ですが、コロイド粒子の持っている電荷と反対の電荷をたくさん持ったものを加えることで、効率よく凝析を行うことができます。
例えば、水酸化鉄(Ⅲ)は正の電荷を持つコロイドです。
硫酸、塩酸、硝酸、リン酸のどれが1番効率よく水酸化鉄(Ⅲ)の凝析を行えるかというと、1番陰イオンの電荷が大きいリン酸になっています。
(画像)
⭐︎ まとめ
塩析とは、親水コロイドに多量の電解質を加えることで、コロイド粒子を析出させること。
凝析とは、疎水コロイドに少量の電解質を加えることでコロイド粒子が析出すること。
凝析をする際は、コロイド粒子の持つ電荷と反対の電荷の価数が1番大きい電解質を選択するのが効率が良い。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】元素の周期律とは?わかりやすく解説!なぜ周期的に性質が変わっていくの?

高校化学の基本が周期表。
周期表はとりあえず原子番号20番まで覚えたけれど、この表に一体どういう意味があるのかわかっていない人はとても多いですよね。
今回は元素の周期律について、言葉の定義や原理・理由をわかりやすく徹底解説していきたいと思います。
ぜひ最後までご覧ください。
⭐︎ (復習)周期表とは
周期表の横の列を周期、縦の列を族といいます。
周期は電子殻の枚数を表していて、族は最外殻電子の数を表しているのでした。
この族の1の位は最外殻電子の数を表しているというのが非常に大切なので、しっかりと押さえておきましょう。

⭐︎ 元素の周期律の定義と成立する理由
族の1の位は最外殻電子の数を表してます。
1族だったら最外殻電子の数は1個だし、17族だったら7個です。
そして、最外殻電子と価電子(化学的性質に関与する電子)の数は希ガスを除いて一致します。
(希ガスの最外殻電子の数は8個ですが、価電子の数は安定なので0個です。)
これをもとに、横軸を原子番号・縦軸を価電子の数としてグラフを作ってみると以下のようになります。

いかがでしょうか。
規則的な周期でグラフが上下しているのがわかると思います。
具体的にいうと、希ガス(18族)で最小・ハロゲン(17族)で最大になっています。
希ガスで0になって、ハロゲンで7をとるというのを繰り返しているグラフになっていることがわかります。
このように、横軸を原子番号・縦軸を化学的性質(この場合は価電子の数)にしてグラフをつくると、特定の周期を持つものが現れます。
これを元素の周期律といいます。
元素の周期律がなぜ確認できるのかというと、周期表の族ごとに価電子の数が一致するようになっているから。
すなわち縦の列ごとに化学的性質が似るようになっているので、同族の元素が来るたびにグラフは似たような値を取り、似たような動きをするグラフを作ることになります。
⭐︎ 価電子以外の原子の周期律
価電子以外の代表的な元素の周期律が見られるグラフとして、イオン化エネルギーがあります。
イオン化エネルギーのグラフは以下の通りです。

ここではイオン化エネルギーの詳しい説明は省きますが、イオン化エネルギーはアルカリ金属で最小・希ガスで最大をとり、元素の周期律がしっかりと現れていることがわかります。
⭐︎ まとめ
元素の周期律とは、原子番号を横軸・化学的性質を縦軸にしてグラフを作ると、特定の周期を持ったグラフが現れること。
元素の周期律は、周期表の族ごとに価電子の数が一致しているからこそ起こる。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】分子の形の見分け方を解説!VSEPR則をわかりやすく解説してみた

共通テストによく出題されがちな分子の形。
よくみる分子だったら対応できるけど、初見の分子には対応できない人が多いですよね。
覚えるしかないのか不安になっている人も多いはず。
今回は分子の形を決定する法則「VSEPR則」について徹底解説していきたいと思います。
応用が入る内容ですが、なるべくわかりやすく解説していきます。
これがわかると分子の形は暗記ではなくなりますので、ぜひ最後までご覧ください。
⭐︎ よく出題される分子の形
よく入試に出題される分子の形として、以下の物質と以下の形があります。

この4種類の物質の形は本当によく入試でみますので、覚えてしまってもいいかもしれません。
ここからは分子の形が決定する原理について確認していきたいと思います。
⭐︎ VSEPR則とは
VSEPR則(原子価殻電子対反発則)とは、分子の形を予測するための法則となっています。
読み方はそのままアルファベット読みです。
VSEPR則は、ざっくりと2つの法則からできています。
(難しい理論なので、分子の形を決定する上で必要な部分だけにしぼっています。)
① 電子のまとまりは反発して、なるべく遠くにいこうとする
② 分子の形は原子がある部分によって作られる
これだけみてもピンとこないと思うので、具体例をもとにVSEPR則について確認していこうと思います。
⭐︎ VSEPR則の具体例〜水は折れ線でなぜ二酸化炭素は直線なのか〜
今回は例として、水と二酸化炭素を用いて説明していきたいと思います。
水は折れ線形で、二酸化炭素は直線形です。
なぜ同じような原子の構造なのに(真ん中に中心元素があって、その両脇に同じ元素がある)、分子の形が異なるのか疑問に抱いている人は多いはずです。今回はそちらの疑問も確認していきたいと思います。
まず、水と二酸化炭素の電子式は以下の通りです。

水の酸素原子の周りには電子のまとまり(電子対ではないです。)が4つ、二酸化炭素の炭素原子の周りには電子のまとまりが2つあるのがわかります。

ここでVSEPR則の1個目の法則です。
「① 電子のまとまりは反発して、なるべく遠くにいこうとする」です。
電子は互いにマイナスの電荷を持っていますので、反発して遠くにいこうとします。
遠くにいこうとした結果が、
水の酸素原子の周りの4つの電子のまとまりは正四面体形に、二酸化炭素の炭素原子の周りの2つの電子のまとまりは直線形になります。
ちなみに、電子のまとまりが中心元素の周りに3つあれば、電子は反発して三角形になります。

つまり、水の場合は電子の形が正四面体形、二酸化炭素は電子の形が直線形なのです。
ここで2つ目の法則を使って、分子の形を決定していきます。
「② 分子の形は原子がある部分によって作られる」です。
原子がある電子は形を作るけど、原子がない電子は分子の形には関与しないのです。
水と二酸化炭素の原子がある部分を繋いでいくと以下のようになります。

よって水は折れ線形、二酸化炭素は直線形になります。
分子の形はVSEPR則によって、
電子の形を決める→分子の形を決めるの順番で決定することができます。
⭐︎ まとめ
VSEPR則とは、分子の形を決定する方法である。
VSEPR則によって、分子の形を決定する手順は以下の通り。
① 電子の形を決める
電子のまとまりは反発することから、電子の形を考える
② 分子の形を決める
分子を作るのは原子なので、原子があるところだけをつなげていく
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】フェノールの4つの製法を解説!アルカリ融解やクロロベンゼンを使った方法も

共通テストなどで聞かれることも多い、フェノールの合成方法。
フェノールの合成方法はたくさんあり、暗記に苦労している人はとても多いですよね。
今回はフェノールの合成方法3種類を、わかりやすく解説していきたいと思います。
ぜひ最後までご覧ください。
(※残りの1種 クメン法はこちらから→◎)
⭐︎ フェノールの合成方法の種類
フェノールの合成には4種類の方法があります。
① クメン法
② ベンゼンスルホン酸からの合成
③ クロロベンゼンからの合成
の4つです。
ここでは、クメン法以外の3種類について解説していきたいと思います。
⭐︎ ベンゼンスルホン酸から合成する方法
ベンゼンスルホン酸からフェノールを作る方法は、以下の3ステップで行われます。

①の工程は、スルホン酸(酸性)と水酸化ナトリウム(塩基性)の中和反応によって、塩であるベンゼンスルホン酸ナトリウムを作っています。
②の工程は、アルカリ融解によってベンゼンスルホン酸ナトリウムのーSO3Naと、水酸化物イオンを置換する反応になっています。
アルカリ融解とは、本来起きることがない置換反応を無理やり起こす反応です。
純粋な水酸化ナトリウムを液体化することで、水酸化物イオンの濃度が濃い状況を作ることができます。
この状態で反応物と混ぜることによって、無理やり水酸化ナトリウムの水酸化物イオンとーSO3Naを置換することができます。

ただし、アルカリ融解によって生成したフェノールは酸ですので、すぐに水酸化ナトリウムと中和反応を起こし、ナトリウムフェノキシドになってしまいます。

そこで工程③では、ナトリウムフェノキシド(弱酸の塩)にそれよりも強い酸性物質を加えることで目的物であるフェノールを弱酸の遊離反応で生成しています。
⭐︎ クロロベンゼンから合成する方法
クロロベンゼンからフェノールを作る方法は、以下の2ステップです。

工程①では、高温高圧条件下にすることによって、本来は起きない水酸化ナトリウムの水酸化物イオンとクロロベンゼンの塩化物イオンが置換されます。
ただし置換によって生成したフェノール(酸性)は、水酸化ナトリウム(塩基性)との中和反応によって直ちにナトリウムフェノキシドになってしまいます。
(スルホン酸により生成する方法のアルカリ融解のときと同じです。)
そこで工程②では、ナトリウムフェノキシド(弱酸の塩)にそれよりも強い酸性物質を加えることで目的物であるフェノールを弱酸の遊離反応で生成しています。
⭐︎ 塩化ベンゼンジアゾニウムの加水分解
塩化ベンゼンジアゾニウムはとても不安定な物質です。
アゾ基の窒素原子は手が4本(本来なら3本が安定)あり、安定な窒素の状態になろうと化学反応を起こそうとします。
よって、不安定な塩化ベンゼンシアゾニウムを加熱することによって、安定な窒素が生成する反応を利用したのが、4つ目のフェノールの合成方法となっています。
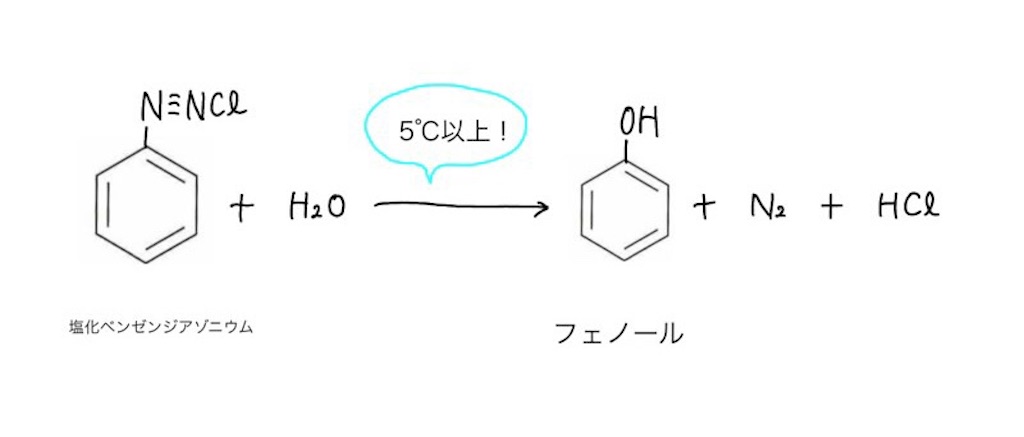
⭐︎ まとめ
フェノールの合成方法は以下の4つである。
① クメン法
② ベンゼンスルホン酸からの合成
③ クロロベンゼンからの合成
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】クメン法の反応式をわかりやすく徹底解説!反応機構や原理など

フェノールの工業的製法の中でも1番問われることが多いのがクメン法。
なんだかごちゃごちゃしていて、覚えるのが大変ですよね。
今回はフェノールの工業的製法であるクメン法について、原理をふまえて徹底解説していきたいと思います。
ぜひ最後までご覧ください。
クメン法とは
クメン法とは、ベンゼンにプロペンを反応させることで工業的にフェノールを生成する方法となっています。
クメン法では、以下の3ステップでフェノールが合成されています。
① プロペンにベンゼンを付加反応させてクメンを作る
② クメンを酸化して、クメンヒドロペルオキシドを作る
③ クメンヒドロペルオキシドを酸で分解してフェノールが生成

ここで疑問を感じる方もいると思います。
「なんでベンゼンに直に水酸化物イオンをくっつけるのではダメなのか」という疑問です。
ベンゼンの周りはπ結合がつながっている、電子雲の状態になっているのでした。
電子雲はその名前の通り電子の集合体ですので、ベンゼンはマイナスに帯電しています。
当然、陰イオンである水酸化物イオンはベンゼンに近づくことができません。
水酸化物イオンを直接ベンゼンにくっつけることは不可能なため、フェノールは少し工程が多いクメン法という工業的製法が採用されています。
ここからは各ステップの細かい原理について確認していきたいと思います。
ステップ① プロペンにベンゼンを付加反応させてクメンを作る
プロペンとは以下の構造を持った化合物です。

これにベンゼンを付加反応させます。
プロペンは二重結合を持っていますので、π結合が切れて付加反応を起こします。
π結合が切れて余った手の片方にはベンゼン、もう片方の余った手には水素がくっつきます。
水素がくっつくのは、マルコフニコフ則より水素が多い方の炭素原子の余った手になります。

これにより生成したのがクメンです。
ステップ② クメンを酸化して、クメンヒドロペルオキシドを作る
この過程を確認するために、皆さんに思い出して欲しい反応があります。
それは、「ベンゼンに直接ついている炭素原子は酸化するとカルボン酸になる」という反応です。
炭素の数が何個であろうと、ベンゼンに直接ついてる炭素は全てカルボン酸になるのでした。

この反応によって、クメンのベンゼン環に直接ついている炭素原子が酸化されカルボン酸になります。
こうしてできたのがクメンヒドロペルオキシドです。

ステップ③ クメンヒドロペルオキシドを酸で分解してフェノールが生成
生成したクメンヒドロペルオキシドを、下のように酸で分解します。

すると目的物であるフェノールと、副産物であるアセトンが生成します。
※ ステップ3については原理については高校の範囲を逸脱していますので説明しません。
が、化学が得意な人へのヒントとして、クメンヒドロペルオキシドがヘミアセタール構造を持っているということを記載しておきます。
まとめ
クメン法とは、ベンゼンとプロペンを3ステップで反応させることでフェノールを合成する方法である。
3ステップは以下の通りである。
① プロペンにベンゼンを付加反応させてクメンを作る
② クメンを酸化して、クメンヒドロペルオキシドを作る
③ クメンヒドロペルオキシドを酸で分解してフェノールが生成
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】ビニロンの作り方・合成方法を徹底解説!なぜ吸湿性がある?アセタール化する理由も

日本人が初めて合成した繊維として有名なビニロン。
ビニロンの合成方法は、大学入試でも記述問題として出題されがちですよね。
今回はビニロンの合成方法について、構造式を交えながら徹底解説していきたいと思います。
入試に記述問題として出題されがちな部分についてもわかりやすく解説していきますので、ぜひ最後までご覧ください。
⭐︎ ビニロンとは
ビニロンは、以下のような構造式をもつ合成繊維の一種です。

1939年に桜田一郎が開発した、日本初の合成繊維となっています。
ビニロンは強度が強く、合成繊維では珍しい「吸湿性をもつ」という特徴を持っています。
ここからはビニロンの合成方法や、吸湿性をもつ理由などについて確認していきたいと思います。
⭐︎ ビニロンの合成方法
ビニロンは以下の3ステップで合成されています。
① 酢酸ビニルを付加重合する
② ①で生成したポリ酢酸ビニルをけん化して、ポリビニルアルコールにする
③ ポリビニルアルコールの20〜30%くらいをアセタール化する
- ここからは各段階について細くみていきたいと思います。
① 酢酸ビニルを付加重合する
酢酸ビニルを付加重合します。

二重結合のπ結合が切れて、ポリ酢酸ビニルが生成します。
② ポリ酢酸ビニルをけん化して、ポリビニルアルコールにする
けん化というのは、塩基を使ったエステルの加水分解のことをいいました。
ポリ酢酸ビニルをけん化することで、ポリビニルアルコールが生成します。

ここで確認してほしいことが1つあります。
「なぜ酢酸ビニルで付加重合した後、けん化をしてポリビニルアルコールを作るという面倒くさい手順を踏んでいるのか」ということです。
最終的にポリビニルアルコールが欲しいのなら、最初からビニルアルコールを付加重合すればいいですよね。
なぜ最初からビニルアルコールを付加重合しないのかというと、ビニルアルコールは不安定なので、ケトエノール互変異性によってアセトアルデヒドになってしまうからです。

よって、ビニルアルコールを付加重合するのは不可能なので、わざわざ酢酸ビニルを付加重合し、けん化することでポリビニルアルコールを作っています。
よく記述問題で出題されますので、押さえておきましょう。
③ ポリビニルアルコールを20〜30%くらいアセタール化する
最後にポリビニルアルコールを20〜30%くらいアセタール化します。
アセタール化というのは、ポリビニルアルコールが持っているヒドロキシ基2個中の水素原子と、ホルムアルデヒドの酸素原子を脱水する操作です。
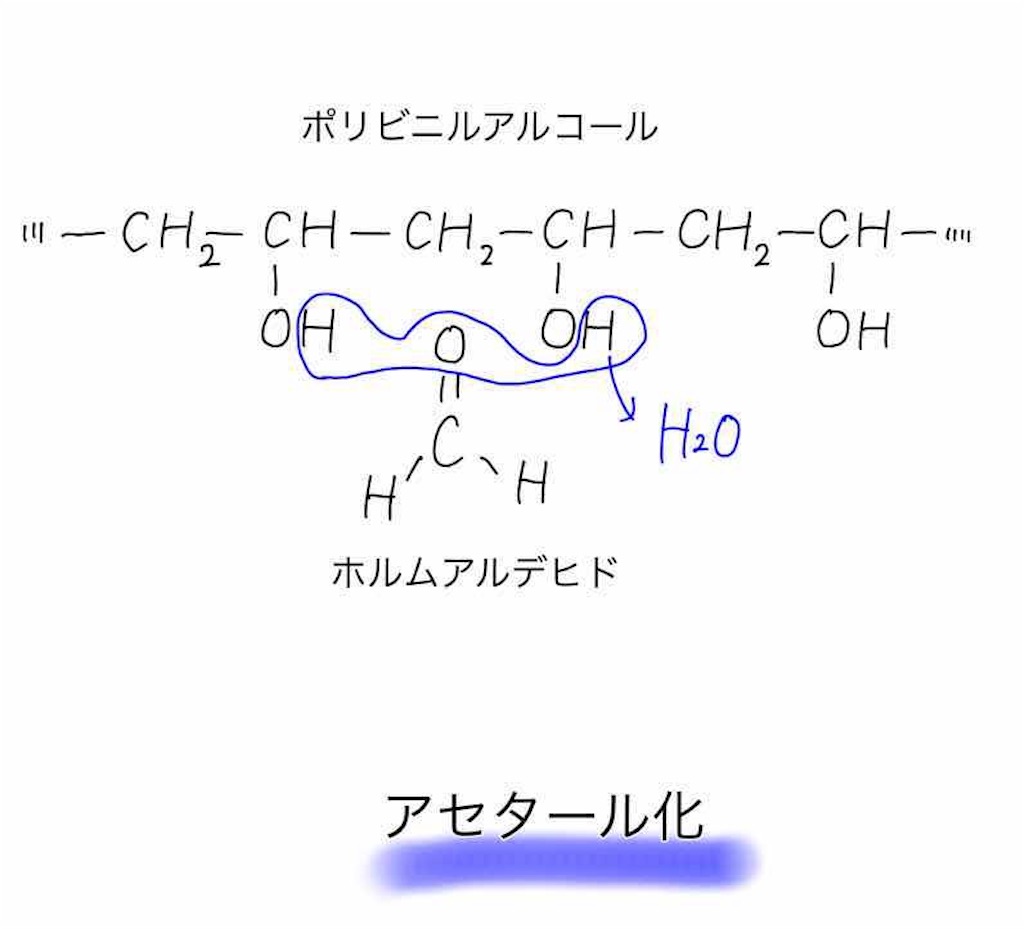
全てのヒドロキシ基をアセタール化するのではなく、大体20〜30%ほどのヒドロキシ基をアセタール化します。
ポリビニルアルコールは、ヒドロキシ基を持っているからこそ水素結合により強力な吸湿性を有します。
アセタール化を一切しないと水分を取り込みすぎて、最終的には繊維が水に溶けてしまいます。
水に溶けてしまっては、本来の繊維としての役割を果たすことができません。
だからといって全てのヒドロキシ基をアセタール化してしまうと、吸湿性が一歳なくなり、本来のビニロンの良さが損なわれてしまいます。
なので、吸湿性を保ちつつ水に溶けないギリギリのラインとして、20〜30%くらいのヒドロキシ基をアセタール化をし、ビニロンは完成となります。

⭐︎ まとめ
ビニロンは以下の3つのステップで合成できる。
① 酢酸ビニルを付加重合する
② ①で生成したポリ酢酸ビニルをけん化して、ポリビニルアルコールにする
③ ポリビニルアルコールの20〜30%くらいをアセタール化する
ビニロンが吸湿性を示すのは、水素結合を有するため。
アセタール化は、ビニロンが完璧に水に溶けないようにするために行われる。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。