【化学基礎】イオンとは一体何なの?イオンの形成やでき方をわかりやすく徹底解説!

こんな風に、イオンの成り立ちについて疑問を覚えている受験生は多いはず。
しかし、イオンの成り立ちは一度わかってしまえば、今後の化学の根本を理解するための大きな手助けになるはずです。
今回はイオンの形成やでき方について、わかりやすい方法で徹底解説していきたいと思います。
理解できれば、とても面白い分野でもあると思いますので、高校化学を勉強中の方、ぜひ見ていってください。
☆ そもそもイオンとは
イオンとは、原子が電子を失ったり、もらったりすることによって、電荷を持つようになった粒子のことをいいます。
プラスの電気を持つ粒子は、陽イオン
マイナスの電気を持つ粒子を、陰イオン
といいますね。
今から、原子が電気を持ってイオンになるまでの過程を見ていきたいと思います。
☆ 全ての元素は希ガスに憧れを持っている
これ本当に大切なので、もう一度書きます。
全ての元素は希ガスの電子配置に憧れています。
そもそも希ガスって何?って方のために、希ガスについて説明すると、
最外殻が閉殻(限界まで電子殻に電子が詰まっている状態)になっている安定な元素のことをいいます。
そう、希ガスは安定なのです。
全ての元素は安定になりたい、つまり、希ガスと同じ閉殻の電子配置になりたいので、
元素は自分が持っている電子をあげたりもらったりして、なんとか希ガスと同じ電子配置になるような反応が起きます。
希ガスと同じ電子配置を目指して、電子のやり取りを行なって生成するのがイオン
とても大事ですので、頭に入れておいてください。
☆ 陽イオンと陰イオンはどのように決まっているのか
希ガスと同じ電子は配置を目指して、電子のやり取りが行われるのは理解したと思います。
では、どういった元素がプラスの電気を持つ陽イオンになって、どういった元素がマイナスの電気を持つ陰イオンになるのでしょうか。

周期表を見て確認しながら進めていきたいと思います。
まず、周期表でいうと1族に属するナトリウムは陽イオンと陰イオンどちらになるのか確認していこうと思います。
・ ナトリウムの場合
ナトリウム原子の電子配置は「K2L8M1」です。
(ナトリウムの原子番号は11。11個の電子がK殻に2個、L殻に8個、M殻に1個という意味です。これからはこの表記で書きます。)
ナトリウムが希ガスと同じ電子配置になるには、
M殻の電子を1個放出するか、電子を7個もらう
のどちらかをすればいいですよね。
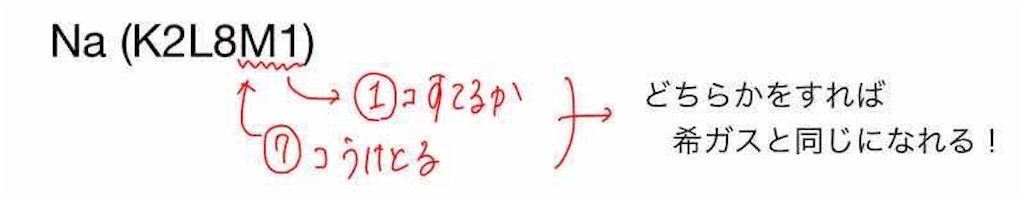
電子を1個放出するのと、電子を7個もらうの、どちらが楽でしょうか。
電子をやり取りする個数はなるべく少ない方が楽です。
よって、ナトリウム原子は電子を1個放出するような反応が起きます。
プラスマイナスが釣り合っている状態から、マイナスの電荷を持つ電子を放出すれば
相対的にプラスになります。
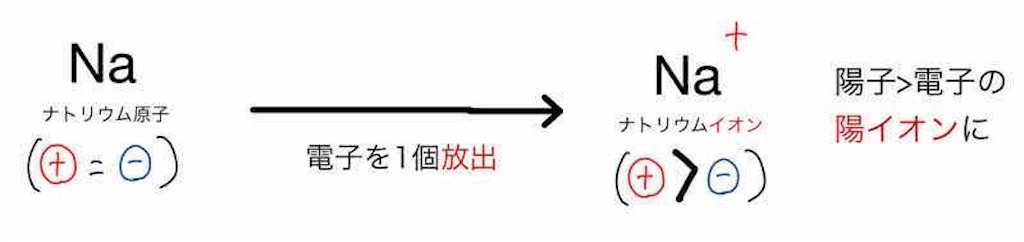
ナトリウムは電子を放出するような反応が起きやすい、
つまり、ナトリウムは陽イオンになりやすい元素です。
ナトリウムのように価電子が少ない元素は、電子をもらって希ガスと同じ電子配置になるよりも
電子を放出して希ガスと同じに電子配置になる方が楽です。
価電子が少ない元素は、陽イオンになりやすい元素といえます。

上の図で囲った部分。アルカリ金属やアルカリ土類金属、遷移元素と呼ばれる部分を囲みました。
これらは全て、価電子が1〜2個で少ない元素となっています。
よって、周期表でいうと左側の元素は陽イオンになりやすいということになります。
・ 塩素の場合
塩素原子の電子配置は「K2L8M7」です。
塩素が希ガスと同じ電子配置になるには、
M殻の電子を7個放出するか、電子を1個もらう
のどちらかをすればいいです。
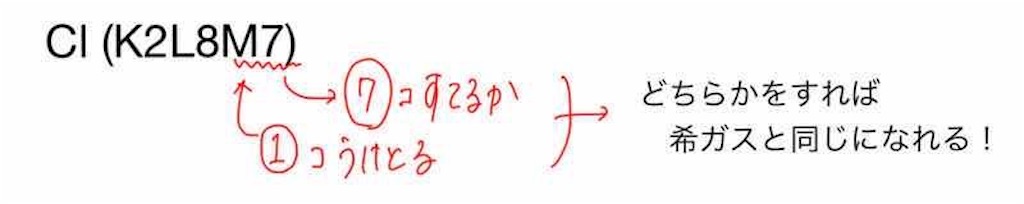
ナトリウムの時と同じように考えてみると、電子を7個放出するのと、電子を1個もらうのだったら
電子を1個受け取る方が楽ですよね。
よって、塩素原子は電子を1個受け取るような反応が起きます。
プラスマイナスが釣り合っている状態から、マイナスの電荷を持つ電子を受け取れば
相対的にマイナスになります。

塩素は電子を受け取るような反応が起きやすい、
つまり、塩素は陰イオンになりやすい元素です。
塩素のように価電子が多い元素は、電子を放出して希ガスと同じ電子配置になるよりも
電子を受け取って希ガスと同じに電子配置になる方が楽です。
価電子が多い元素は、陰イオンになりやすい元素といえます。

上の図で囲った部分。15〜17族と呼ばれる部分です。
これらは価電子の数が多いので、電子を受け取るような反応がおきますね。
よって、周期表でいうと右側の元素は陰イオンになりやすいということがわかります。
・ 14族はどちらのイオンになるのか
では、真ん中にある14族はどちらのイオンになるのでしょうか。
結論から言うと、14族の元素はイオンにはなりづらいです。
例えば、14族の炭素元素で確認してみましょう。
炭素の電子配置は「K2L4」です。
炭素が希ガスと同じ電子配置になるためには、電子を4つ放出するか、4つ受け取るかのどちらかをしなくてはいけません。

4つの電子の移動って、結構大掛かりなんですよ。
4つ電子をもらうのも大変だし、4つ電子を放出するのも大変です。
4つの電子の移動を伴ってまで、元素は希ガスと同じ電子配置になろうとは思いません。
よって、炭素は電子の移動を起こさない、イオンになりづらい元素だといえます。
☆ まとめ

イオンとは、希ガスと同じ電子配置になるために電子のやり取りを行なった結果、電荷を帯びるようになった粒子のこと
右側は陰イオンになりやすい
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。