【高校化学】アルミニウムの工業的製法である融解塩電解(溶融塩電解)の原理をわかりやすく解説!普通の電気分解と違うの?

アルミニウムの工業的製法である融解塩電解。
普通の電気分解と何が違うのかが曖昧な受験生の方も多いですよね。
アルミニウムの融解塩電解は丸暗記では入試問題には対応できず、原理をしっかりと理解しておく必要があります。
今回はアルミニウムの工業的製法である融解塩電解の原理と、普通の電気分解の違いについて徹底解説していきたいと思います。
論述問題で聞かれがちなところでもありますので、確実に理解しておきましょう。
☆ アルミニウムの工業的製法
アルミニウムは自然界において、ボーキサイトという鉱山中に多く含まれている物質として存在しています。
ボーキサイトというのは主成分が酸化アルミニウムAl2O3、不純物としてFe2O3が含まれている物質となっています。
ボーキサイトから純粋なアルミニウムを得る手順は大きく分けて2ステップです。
① ボーキサイトから不純物Fe2O3を取り除いて、純粋なAl2O3(これをアルミナといいます。)を得る
② アルミナを溶解塩電解して、純粋なアルミニウムを得る(これがメイン!)
になります。
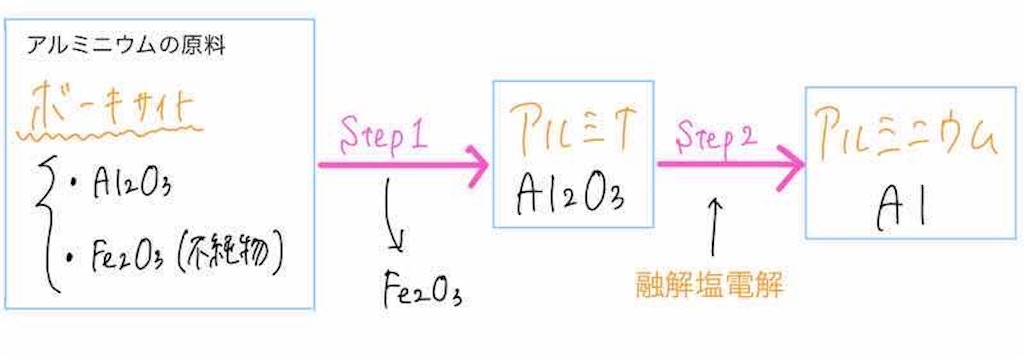
ステップ①、②と2段階に分けて説明していきたいと思います。
☆ ステップ① ボーキサイトから不純物を取り除いて、純粋なアルミナを得る
ボーキサイトからアルミナをとる方法のことをバイヤー法といいます。
ボーキサイト、アルミナ、バイヤー法の3つの単語はよく穴埋め問題で出題されますので、覚えておきましょう。
バイヤー法のざっくりとした流れは
アルミニウムだけを溶かして、ろ過! …(1)
溶けているアルミニウムを、固体(アルミナAl2O3)に戻す! …(2)
です。

細くみていきましょう。
(1)アルミニウムだけを溶かす方法
アルミニウムだけを溶かして、不純物は固体のままだったら、ろ過をすればアルミニウムと不純物とを分けることができます。
ここで思い出してほしいのは、アルミニウムは両性元素だということ。
両性元素の単体あるいは酸化物は、酸にも塩基にも溶けるという性質を持っています。
(ついでにいうと、両性元素以外の金属も酸には溶けますが、塩基には溶けません。塩基に溶けるのは両性元素の特権です。)
なので、強塩基である水酸化ナトリウムNaOHをボーキサイトに入れれば、
メインのアルミニウムは溶けて、不純物(Fe2O3)は溶けません。
ろ液にあるアルミニウムだけを不純物と分離することができます。
(2)融解塩電解をするために固体に戻す
この後の電気分解の電解液にするために、アルミニウムを固体に戻す作業をします。
ろ液を水で薄めると、ろ液中にあったアルミニウムの錯イオンは、水酸化アルミニウムになります。

水で薄めると水酸化物イオンの濃度が下がります。
すると、ルシャトリエの法則で水酸化物イオンの濃度が増える方向へと反応が進むので、水酸化アルミニウムが生成するのですね。
最後に、この水酸化アルミニウムを

加熱して上記の反応を起こし、純粋なアルミナAl2O3を生成します。
☆ ステップ② 溶解塩電解
・そもそも溶解塩電解とは
やっとメインの溶解塩電解に入っていきます。
その前に溶解塩電解とは何なのかを確認しておきましょう。
溶解塩電解は電解液に水がない状態で電気分解する方法であり、
イオン化傾向が水素より小さい金属の単体を生成するときに使います。
大切なのでもう一度言います。
電解液に水がないのです。
電解液は金属などの固体を溶かして液体にしたものを用います。
(だから、溶解、塩電解というんですね。金属を溶解した電解液を使うから。)
・アルミニウムの溶解塩電解の基本的な装置
アルミニウムの溶解塩電解をみていきたいと思います。
電気分解の知識を忘れてしまった方は、こちらのページで確認してください。
【高校化学】電気分解の各極のイオン反応式の作り方やルールを徹底解説!フローチャート通りにやれば簡単に作れる - 化学の偏差値が10アップするブログ
アルミニウムの溶解塩電解は、
電極:陽極陰極どちらも炭素、 電解液:アルミナと氷晶石を溶かしたもの
で行います。

(しつこいですが、水はないです。強調するためにバッテンを水につけました。)
ちなみに氷晶石の役割はとても大切です。入試問題に何度論述で出題されたことでしょうか、笑
氷晶石の化学式はNa2AlF6です。
そして、先ほども言ったように、溶解塩電解の電解液は金属を溶かしたものでなくてはいけません。
つまり、この場合はアルミナを溶かさないといけません。
アルミナの融点は2000度でめっちゃ高いです。これを溶かすのってとても大変。
ここで出てくるのが氷晶石で、凝固点降下剤として使用します。
氷晶石って電離すると

こうなります。氷晶石1分子から9分子分のイオンが発生するのです。
凝固点降下は溶媒に対する溶質粒子の数が多いほど、大きくなるのでしたね。
氷晶石由来の9つ分のイオンによって、アルミナの融点は960度ほどまで下がります。
氷晶石のおかげで、アルミナを溶かすことができるのです。
・アルミニウムの溶解塩電解の原理
では、基本的な電気分解のルールに則って、各極のイオン反応式を作っていきたいと思います。

(陽極)
電子を放出する反応が起きます。
① 電極をみる
炭素なので安定 → 反応なし
② 電解液をみる
ハロゲンなし → 水の電気分解によって酸素発生
→ 水もない!
いつも通り手順に従って、陽極のイオン反応式を作ろうとしましたが、溶解塩電解では水がないので酸素が発生できません。
なので、最終手段として安定な炭素電極が二酸化炭素となって溶け出すような反応が起きます。

水がないからこそ起きる特殊な反応ですね。
考えてわかる反応式ではないですので、しっかりと暗記してください。
(陰極)
電子を受け取る反応が起きます。
① 電解液をみる
イオン化傾向が水素より小さい金属のイオンなし → 水の電気分解によって水素発生
→ 水もない!
陽極と同じように、ルールに従ってイオン反応式を作りましたが、こちらも水が存在しません。
なので、水素が発生できない。では、どういう反応が起きるのかというと

最終手段として、電解液中のアルミニウムイオンが電子を受け取って、アルミニウムの単体になります。
普通の電気分解では水があるので、イオン化傾向が水素より小さい元素は単体として析出できません。
溶解塩電解で水をなくすことによって、普段は析出することのないイオン化傾向が水素より小さい元素の析出を可能にするのです。
個人的には良く練られた面白いシステムだなと思います。
普段は析出することない金属単体を生成することができるので、溶解塩電解はイオン化傾向が小さいナトリウムの生成にも使われています。
(ナトリウムは水と爆発的に反応しちゃうし、水を使わない溶解塩電解は大きなメリットがありますね。)
☆ まとめ
アルミニウムは溶解塩電解という、水を使わない電気分解によって生成している。
水がないからこそ

の反応が起こる。
溶解塩電解は普通の電気分解では生成しない、イオン化傾向が小さな金属の単体を析出するのに適した方法である。
また、氷晶石の役割は、
アルミナの融点を下げるため、アルミナの凝固点降下を促進するため
である。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。