【化学基礎】塩の加水分解をわかりやすく徹底解説!なぜ強酸と弱塩基の塩は酸性になるの?

弱酸と強塩基の塩は塩基性になる
強酸と弱塩基の塩は酸性になる
塩の液性は「強い方が勝つ」とこちらのページで学習しました。
ただ、その原理についてはしっかりと理解できていない化学学習者の方は多いのではないのでしょうか。
今回は
弱酸と強塩基の塩は塩基性になる、強酸と弱塩基の塩は酸性になる理由である
塩の加水分解の原理についてわかりやすく徹底解説していきたいと思います。
入試問題において、記述で問われる分野でもありますので、ぜひご覧になっていってください。
☆ 塩の加水分解とは
塩の加水分解とは、
塩が水分子と反応することによって、分解してしまうことをいいます。
ここでいう「塩」とは、酸と塩基の中和反応によって生成したものです。
塩はイオン性の物質ですので、水中においては電離して存在しています。
このことをしっかりと押さえて、塩の加水分解の原理に向き合っていきたいと思います。
☆ 復習、強酸・強塩基と弱酸・弱塩基の違いとは
そもそも強酸・強塩基と弱酸・弱塩基の違いは何だったでしょうか。
強酸・強塩基とは、
完全に電離して、H+あるいはOH -をたくさん放出するもの
弱酸・弱塩基とは、
ほぼ電離しておらず、H+あるいはOH -をあまり放出しないもの
となっています。
弱酸・弱塩基は電離しない、これを言い換えると
弱酸・弱塩基はイオンの状態であるよりも分子の状態でいた方が安定であるということを意味します。
よって、弱酸・弱塩基のイオンは
水中では分子に戻ろうとする反応を起こします。
☆ 塩の加水分解の原理
具体例を出しながら、塩の加水分解についてしっかり説明していきたいと思います。
・ 酢酸ナトリウムの塩の加水分解
酢酸ナトリウムは酢酸(弱酸)と水酸化ナトリウム(強塩基)によってできた塩です。
塩の液性は「強い方が勝つ」ので、酢酸ナトリウムは塩基性を示します。
その詳しい原理を見ていきたいと思います。
まず、酢酸ナトリウムは先ほども述べたように、酢酸と水酸化ナトリウムの中和反応によって生成します。
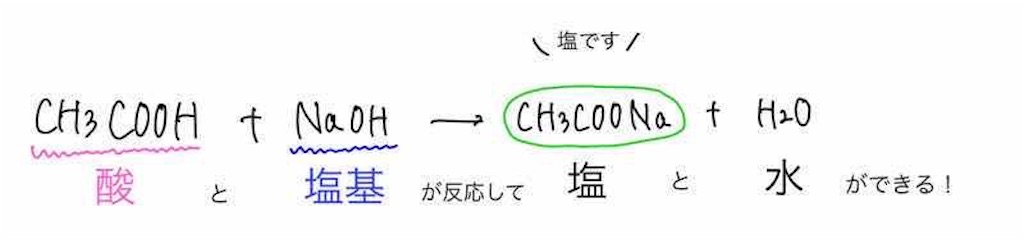
H+とOH −は出会って水に、酢酸イオンとナトリウムイオンが出会って酢酸ナトリウムになるわけです。
一般的な中和反応ですね。
しかし、酢酸ナトリウムは塩ですので、出会ったらすぐに電離をしてしまいます。

ここで考えて欲しいのですが、
ナトリウムイオンは強塩基由来のイオンなので、電離度が高い。すなわち、イオンの状態(=電離した状態)の方が安定です。
しかし、酢酸イオンは弱酸由来のイオンなので、電離度が低い。すなわちイオンの状態でいるのは不安定です。
なので、水分子からH+を受け取って、酢酸分子に戻ろうとするような反応を起こします。

酢酸イオンがH+を水分子が受け取ると、酢酸分子とOH−が生成します。
OH−が生成するので、酢酸ナトリウムの液性は塩基性になるのです。
塩の加水分解とは、言い換えると
弱酸・弱塩基が分子に戻ろうとして、水と反応する現象ともいえます。
・ 塩化アンモニウムの塩の加水分解
塩化アンモニウムは塩酸(強酸)とアンモニア(弱塩基)によってできた塩です。
塩の液性は「強い方が勝つ」ので、塩化アンモニウムは酸性を示します。
先ほどと同様に、その詳しい原理を見ていきたいと思います。
塩化アンモニウムは、塩酸とアンモニアの中和反応によって生成します。

アンモニアはブレンステッドローリーの塩基なので、電離してOH−を放出しているのではなく、水分子からH+を受け取ってアンモニウムイオンと水酸化物イオンになっていることには注意が必要です。
そして、一般的な中和反応と同じように、H+とOH −は出会って水に、塩化物イオンとアンモニウムイオンが出会って塩化アンモニウムの塩になるわけです。
しかし、塩化アンモニウムは塩ですので、出会ったらすぐに電離をしてしまいます。

先ほどの酢酸ナトリウムと流れは同じです。
塩化物イオンは強酸由来のイオンなので、電離度が高い。すなわち、イオンの状態(=電離した状態)の方が安定です。
しかし、アンモニウムイオンは弱塩基由来のイオンなので、電離度が低い。すなわちイオンの状態でいるのは不安定です。
なので、アンモニウムイオンは水分子にH+を渡して、アンモニア分子に戻ろうとするような反応を起こします。
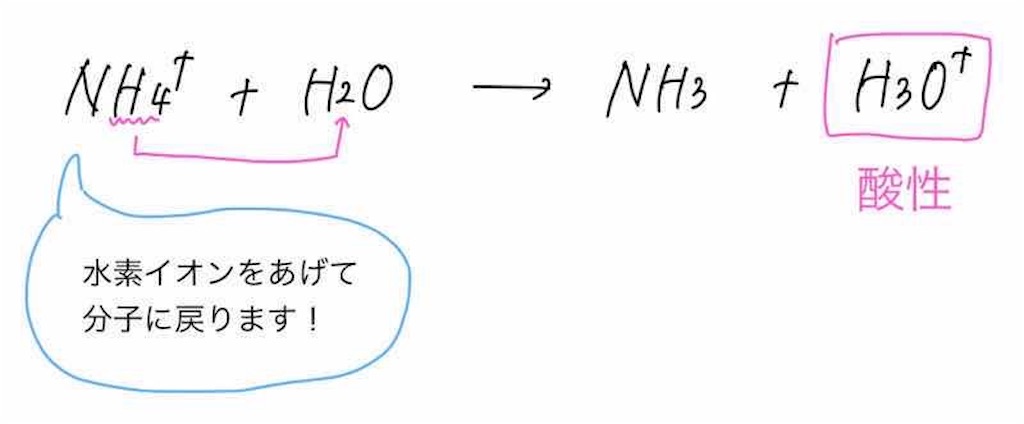
アンモニウム分子が水分子にH+を押し付けると、水分子はオキソニウムイオンに変化します。
酸の成分であるH+は厳密にいうと、オキソニウムイオンとして存在しているのでしたね。
よって、オキソニウムイオン(=酸の成分)が存在するのだから、塩化アンモニウムの液性は酸性を示します。
☆ まとめ
塩の加水分解とは、
弱酸・弱塩基が分子に戻ろうとする現象のことである。
弱酸+強塩基は塩の加水分解によって、OH−を放出するので塩基性を示す。
強酸+弱塩基は塩の加水分解によって、H3O+を放出するので酸性を示す。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。