【高校化学】活性化エネルギーとは一体なに?わかりやすく徹底解説!触媒との関係性も【反応速度】

活性化エネルギー。
名前はなんとなく聞いたことあるけど、一体それが何なのかをしっかりと理解している人はなかなかいないですよね。
今回は、活性化エネルギーとは一体何なのかを徹底解説していきたいと思います。
入試においては、語句問題であったり、反応速度と絡めた論述問題として出題されることが多い分野ですので、しっかりと定着させていきましょう。
☆ 活性化エネルギーとは
活性化エネルギーとは、
物質が化学反応を起こすために必要なエネルギーのことをいいます。
活性化エネルギーと同等のエネルギーを物質に加えてあげると、化学反応が起きるようになります。
ここからは、言葉の表面的な意味だけではなく、
そもそも化学反応はどのように起こるのかという観点から、活性化エネルギーについて深掘りしていきたいと思います。
☆ 化学反応が起こる原理
みなさん、化学反応がどのように起こるか知っていますか。
今から、水素とヨウ素がヨウ化水素になる反応を用いて、
化学を勉強する人が間違えやすい、誤った考え方を披露していきます。

・ 化学反応の原理について、間違った考え方
化学を勉強する人は、こういう誤った考え方をしがちです。

ヨウ素分子と水素分子はそれぞれ完璧にバラバラになって、ヨウ素原子と水素原子に
原子になった状態から、改めてヨウ素原子と水素原子が結合を作り、ヨウ化水素分子になるのではないか
…このような考え方はNGです。
なぜなら、化学反応を起こすとき、ヨウ素も水素も原子にはなりません。
・ 正しい化学反応の原理
ここからが正しい原理です。
ヨウ素と水素が化学反応を起こしたいとき、ヨウ素と水素は原子になるのではなく
活性錯合体というものを作って、そこからヨウ化水素分子になります。
物質が化学反応を起こしたいとき、分子は熱運動によって衝突を繰り返します。

分子は衝突を繰り返すことによって、原子になるのではなく
活性錯合体という、曖昧な状態の物質になります。

活性錯合体というのは、全ての結合が完全に切れてはないけど、くっついてもいない状態を指します。
上の図のように、ヨウ素原子同士、水素原子同士が完璧につながっているわけではないけど、切れてもいない
ヨウ素原子と水素原子も、完全に繋がってはいないけど、結合が切れているわけでもない
そのような、不安定な状態となっています。
物質は活性錯合体になった後、目指すべき生成物となります。

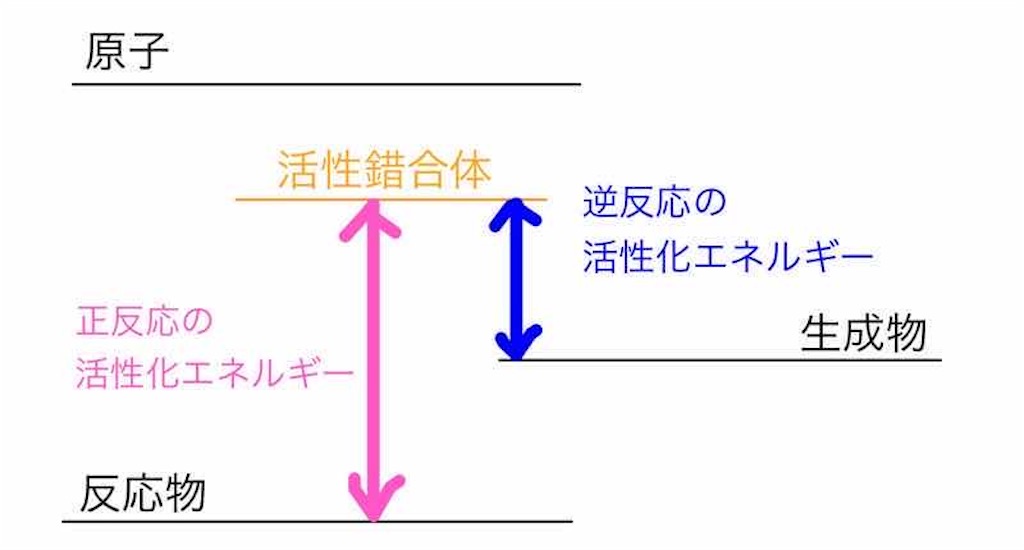
原子、分子、活性錯合体、それぞれのエネルギー順位をエネルギー図で表すとこのようになります。

基本的に、バラバラな状態のものほど、エネルギーを多く持っています。
よって、活性錯合体のエネルギー順位は、分子と原子の間です。
化学反応は、活性錯合体になることさえできれば、滞りなく進行します。
物質が活性錯合体になれさえすれば、化学反応は起こるのです。
物質が活性錯合体になるために必要なエネルギー、すなわち
物質が化学反応を起こすために必要なエネルギーを活性化エネルギーといいます。
図で表すと下の通りです。
☆ 活性化エネルギーと触媒の関係性
活性錯合体は一つの化学反応において、何種類か存在します。
その種類の中でも、1番作られやすい活性錯合体を経て、物質は化学反応を起こしているのです。
本来は作られにくい別の活性錯合体を作りやすくするものを、触媒といいます。
触媒は、化学反応を起こすスピードを速めるもの、というイメージがありますが
触媒は、本来は作られづらいエネルギー順位の低い活性錯合体を経由するようにすることによって、
反応速度を早めているわけです。

ちなみに、エネルギー順位が低い活性錯合体だけではなく、エネルギー順位が高い活性錯合体を作りやすくする触媒もあります。
そういった触媒を負触媒といって、病気の進行を遅らせる薬なんかに使われていたりします。
☆ まとめ
化学反応は、活性錯合体を経ておこっている。
活性錯合体になるために必要なエネルギーが、活性化エネルギーである。
触媒は、違う活性錯合体を作るように促すため、反応スピードを高める(時には遅める)ことができる。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。