【高校化学】酸化数の原理を徹底解説!酸化数とは。過酸化水素や水素化ナトリウムなどの例外も

酸化還元の範囲の入試問題で、やたらと計算することになる酸化数。
計算方法だけはなんとなくわかるけど、それがなんなのか、原理ははっきりわかっていないままの人はとても多いですよね。
今回は酸化数の原理について、わかりやすく解説していきたいと思います。
原理がわかれば、酸化数の「例外」も理論的に腑に落ちると思います。
ぜひ最後までご覧ください。
※ 今回は酸化数の求め方ではなく、原理を中心に解説します。計算についてはこちら→◎
⭐︎ 酸化数の原理のための基本知識
酸化数の原理を理解するためには、酸化還元の定義と電気陰性度を理解しておく必要があります。
まずは酸化と還元の定義についてです。
酸化とは、電子を失うこと
還元とは、電子を受け取ること
をいいました。
電気陰性度とは、共有電子対を引っ張る力の度合いのことを指します。
電気陰性度はフッ素が全元素の中で最大で、周期表でフッ素に近いほど電気陰性度は大きくなります。
以上をふまえて、酸化と還元の定義について確認していきましょう。
⭐︎ 酸化数の原理
酸化数とは、物質のもつ電子が基準よりもどれだけ増減したかを表す数値となっています。
あくまでも増減を表しているので、「1」の場合は「+1」とプラスの場合も符号をつけて表します。
(符号なしの絶対値だと、増えたのか減ったのかがわかりません。)
原理を元に、例として酸素分子(単体)の酸化数を求めていきたいと思います。
酸素分子の電子式は以下のようになります。

酸素原子同士の間には共有電子対が2個あります。
同じ酸素ですので、当然、それぞれの酸素原子の電気陰性度の値は同じになっています。
それぞれの酸素原子が同じ力で共有電子対を引っ張っているので、酸素の間にある共有電子対は2つの酸素のちょうど真ん中に位置することになります。

よって、どちらの酸素も電子の増減はないので酸化数は「0」になります。
一方、今度は化合物の例として水分子のそれぞれの原子の酸化数を求めていきたいと思います。
水分子の電子式は以下のようになっています。

水素と酸素の間には共有電子対があります。
水素よりも酸素の方が電気陰性度が高いので(=酸素の方が周期表でフッ素に近い)、水素と酸素原子の間にある共有電子対は酸素がわに偏ってくることになります。

本来、酸素原子の最外殻電子の数は6個、水素原子の最外殻電子の数は1個です。
けれども、電気陰性度が高い酸素が共有電子対を取り込んでいるので、酸素の実際の最外殻電子の持ち分は8個、水素は0個となっています。

よって、本来の基準よりも酸素は2個電子が多い状態、水素は1個電子が少ない状態になっています。
電子はマイナスの電荷を持っていますので、水分子の酸素原子の酸化数は「−2」、水素原子の酸化数は「+1」となります。
⭐︎ 酸化数のルールから外れる過酸化水素と水素化ナトリウム
ここで酸化数のルールの例外として扱われることが多い、過酸化水素の酸素原子、水素化ナトリウムの水素原子について、原理に基づいて見ていきたいと思います。
基本的に酸素の酸化数は「−2」、水素の酸化数は「+1」です。
けれども過酸化水素と水素化ナトリウムの酸素・水素原子だけは例外で他の値をとります。

水素よりも酸素の方が電気陰性度が大きいので、水素と酸素の間にある共有電子対は酸素側に偏っています。
一方、酸素と酸素の間にある共有電子対は同じ原子同士ですので電気陰性度が等しく、ちょうど真ん中に位置しています。
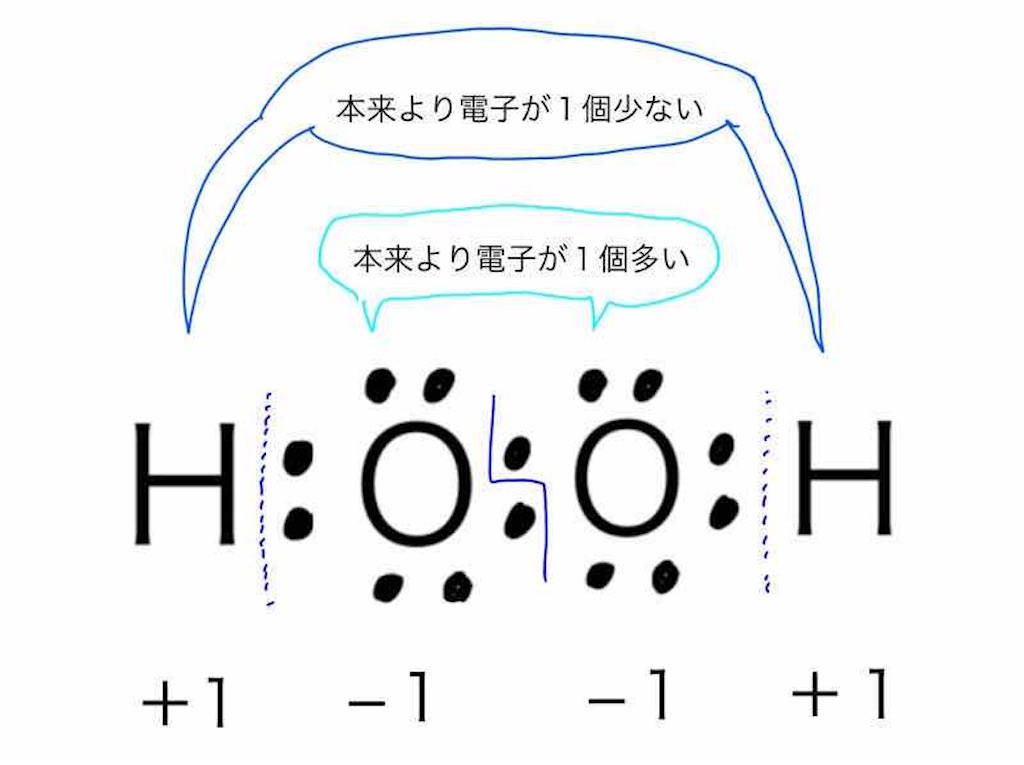
過酸化水素の水素原子は本来の最外殻電子数の1よりも電子が1個少ない状態、酸素原子は本来の最外殻電子数の6よりも1個多い状態になっています。
よって、過酸化水素中の酸素原子の酸化数は「−1」となり、ルール上の酸化数とは例外となります。
次に、水素化ナトリウムについて確認していきます。
水素化ナトリウムの電子式は以下の通りです。

水素とナトリウムの電気陰性度ですが、水素よりもナトリウムの方が電気陰性度が小さいです。
なので、水素とナトリウムの間にある共有電子対は水素側に偏っている状態になります。

水素かナトリウムの水素原子は本来の最外殻電子数の1よりも電子が1個多い状態、ナトリウム原子は本来の最外殻電子数の1よりも1個少ない状態になっています。
よって、水素化ナトリウム中の水素原子の酸化数は「−1」となり、ルール上の酸化数とは例外となります。
⭐︎ まとめ
酸化数とは、物質のもつ電子が基準よりもどれだけ増減したかを表す数値のこと。
原理上は、電気陰性度の大きい原子に共有電子対を取り込んだものとして考えている。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。