【高校化学】イオン限界半径比の求め方を徹底解説!【塩化ナトリウム型や塩化セシウム型】

イオン結晶の限界半径比は計算方法がいまいち分からず、値を丸暗記している人も多いですよね。
値を丸暗記で解ける問題も少しはありますが、大抵の入試問題では文字式を用いていたり、計算過程を記入することを求められます。
今回は、イオン結晶の限界半径比の求め方について、わかりやすく解説していきたいと思います。
イオン結晶の代表的な構造として、塩化ナトリウム型と塩化セシウム型がありますが、どちらも計算過程こみで紹介していますので、ぜひ最後までご覧ください。
☆ イオン限界半径比とは
突然ですが、金属結晶とイオン結晶の大きな違いはどこかわかりますか?
イオン結晶の単位格子は、塩化ナトリウム型と塩化セシウム型が主にありますが、どちらも金属結晶の単位格子とよく似た粒子配列をとっています。
塩化ナトリウム型は、陽イオンと陰イオンがそれぞれ金属結晶の面心立方格子のように配列していて
塩化セシウム型は、陽イオンと陰イオンを合わせて体心立方格子のように配列しています。

金属結晶とイオン結晶の大きな違いは、
金属結晶は同じ元素の粒子のみが集合していて、
イオン結晶は陽イオンと陰イオンが交互に並んでいるということです。
金属結晶と違って、イオン結晶はプラスとマイナスの電気に帯電した粒子が交互に並んでいるので、
同じ電荷を持つ粒子が隣接した瞬間、結晶は崩れてしまいます。
イオン限界半径比とは、イオン結晶が崩れないギリギリの陰イオン半径と陽イオン半径の比のことを言います。
イオン結晶の陰イオンの大きさを一定にして、陽イオンの大きさを小さくしていくと、やがて陰イオン同士がくっつく瞬間がありますよね。

この瞬間の陽イオンと陰イオンの半径比がイオン限界半径比となっています。
イオン限界半径比が、イオン結晶としての形を保つことができるギリギリのラインで
イオン限界半径比よりも、陰イオンに対する陽イオンの比が小さくなると、イオン結晶は壊れてしまいます。
☆ イオン限界半径比の求め方
陽イオンのイオン半径をr+、陰イオンのイオン半径をr−とします。
・塩化ナトリウム型
塩化ナトリウム型は面心立方格子に似ているので、側面を使って計算していきます。
側面をピックアップすると、下のようになります。

この図を使って計算すると

よって、塩化ナトリウム型の限界半径比は0.73です。
・塩化セシウム型
塩化セシウム型は体心立方格子に似ているので、対角線上の断面を使って計算していきます。
斜めの断面図をピックアップすると、下のようになります。
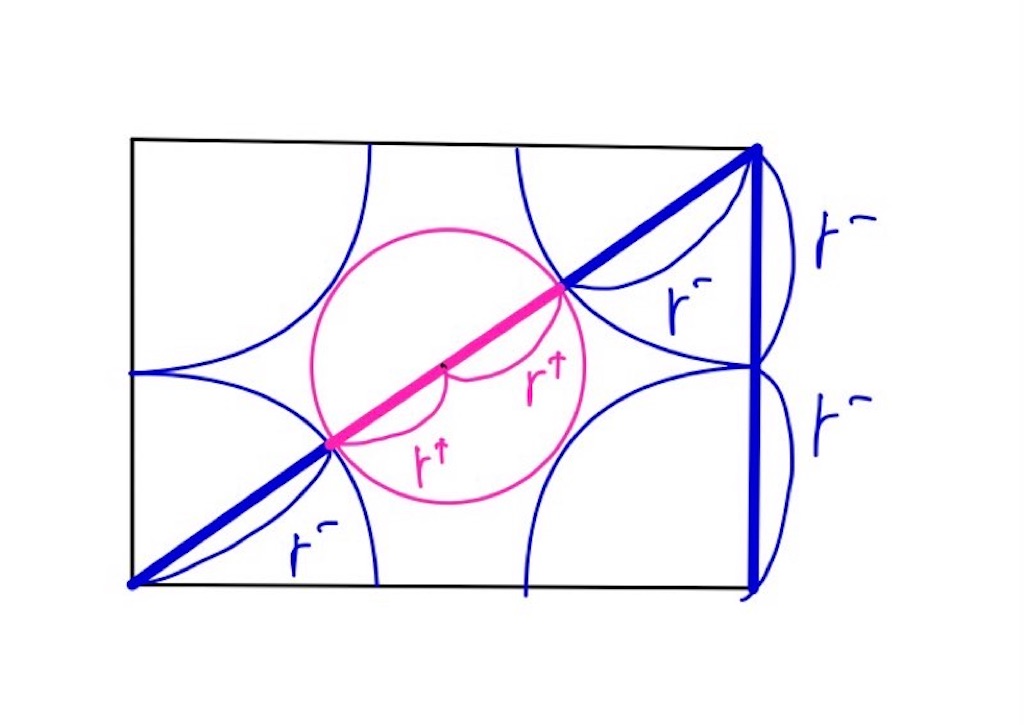
この図を使って計算すると、

よって、塩化セシウム型の限界半径比は0.41です。
☆ まとめ
イオン限界半径比とは、イオン結晶が崩れることのないギリギリの陽イオン半径と陰イオン半径の比である。
塩化ナトリウム型の限界半径比は0.73
塩化セシウム型の限界半径比は0.41である。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。