【化学基礎】塩の液性の見分け方、酸性・塩基性・中性はどのように決まっているの?

塩の液性を問う問題。なんとなくで問題を解いている人も多いかと思います。
なんなら、塩の液性は暗記だと思っている人も多くいますよね。
実は液性を見分ける方法は、コツがわかってしまえばとても簡単です。
今回は塩の液性の見分け方を、簡単にわかりやすく徹底解説したいと思います。
ぜひ、ご覧になってください。
☆ 中和における塩とは
ここでは中和の分野における塩について話をしておきます。
塩とは、酸と塩基の中和反応によって、水と一緒に生成するものです。
つまり、塩というのはもともと「酸」と「塩基」によって作られたわけですね。

☆ 酸と塩基の強弱
塩の液性を見分けるために欠かせない知識として、「酸あるいは塩基の強弱」があります。
その物質が強い酸なのか弱い酸なのか、あるいは強い塩基なのか弱い塩基なのかというのは、考えてわかるものではありません。
率直に言えば、暗記するしかないものとなっています。
下の図に、酸と塩基の強弱について載せておきますので、絶対に覚えてください。
この表を覚えておけば、酸と塩基の色々な範囲で役に立ちます。
(画像)
基本的には頑張って覚えるしかないのですが、少しだけ覚えるコツがあるとしたら、
アルカリ金属やアルカリ土類金属の水酸化物は強塩基で、それ以外は弱塩基だということ。
(ちなみにMgは2属ですが、アルカリ土類金属ではなかったですね。なのでMgの水酸化物は弱塩基です。)
これを覚えれば、酸と塩基の範囲の理解がぐんと楽になるので頑張りましょう。
☆ 塩の液性の見分け方
塩の液性の見分け方の大原則は「強い方が勝つ!」です。
しかもわりと簡単で
① 材料の酸と塩基が何かを調べる
② 強い方がどちらか確認
の2ステップで判断できてしまいます。
理解すればこの手の問題は得点源となりますので、しっかり確認していきましょう。
① 材料の酸と塩基が何かを調べる
塩というのは、先程も確認したように元は酸と塩基の中和反応によってできたものです。
塩というのはつまり、もともとは酸と塩基だったわけです。

ということで、塩がもともとどういう酸とどういう塩基からできたのかを調べるのがステップ1となっています。
例として、酢酸ナトリウムをみていきたいと思います。
酢酸ナトリウムは電離すると、酢酸イオンとナトリウムイオンになります。
ということは、もともと酢酸イオンやナトリウムイオンを持っていた酸や塩基から生成したということがわかります。

先ほど覚えた上の表から、酢酸イオンCH3COO−とナトリウムイオンNa+を持っているものは見つけられるでしょうか。
そうです。
酢酸CH3COOHと水酸化ナトリウムNaOHが酢酸イオンとナトリウムイオンを持っていますね。
よって、酢酸ナトリウムのもとの酸と塩基は、酢酸と水酸化ナトリウムだということがわかります。

② 強い方がどちらか確認
もう一度先ほどの図を確認してみてください。
酢酸は弱い酸、すなわち弱酸です。
水酸化ナトリウムは強い塩基、すなわち強塩基です。
弱酸と強塩基の中和によって生成した酢酸ナトリウムの液性は、何性でしょうか。
塩の液性では、弱い方の性質は打ち消されて、強い方が勝ちます。
よって、弱い酸と強い塩基の中和反応では強い方の性質、すなわち塩基性の性質が打ち勝つので
酢酸ナトリウムの液性は塩基性となります。

☆ 練習問題にチャレンジ
①もともとの酸と塩基を見分けて、②強い方を確認する
酸と塩基の強弱さえ頭に入っていれば、結構簡単に判断できると思います。
この手の問題に慣れていくために、練習問題にチャレンジしていきたいと思います。
(例題)次の塩の液性を判断しなさい。
1.硝酸アンモニウム NH4NO3
2.塩化ナトリウム NaCl
3.炭酸カルシウム CaCO3
(答え)
1.酸性 2.中性 3.塩基性
(解説)もとの酸と塩基、その強弱のみ確認していきます。
1.もとの酸は硝酸(強酸)、もとの塩基はアンモニア(弱塩基)、強い酸と弱い塩基は強い酸が勝つので酸性
2.もとの酸は塩酸(強酸)、元の塩基は水酸化ナトリウム(強塩基)、強い酸と強い酸は引き分けなので中性
3.もとの酸は炭酸(弱酸)、元の塩基は水酸化カルシウム(強塩基)、弱い酸と強い塩基は強い塩基が勝つので塩基性
☆ まとめ
塩の液性は、
① もとの酸と塩基を見分ける ② どちらが強いか確認
の2ステップで判断することができる。
酸と塩基の強弱は表を使ってしっかり覚えること
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】冷却曲線と凝固点降下の関係性を徹底解説!過冷却はなぜ起こるの?

凝固点降下の分野で出てくるのが、冷却曲線の問題です。
冷却曲線は最終的には下へと傾いていますが、その理由は何なのか
そもそも過冷却とは何なのか、など。
記述問題が問われやすい分野となっています。
今回は、凝固点降下の分野でよく問われる冷却曲線について、原理から徹底解説していきたいと思います。
冷却曲線と状態図の関係性、過冷却とは何なのかをわかりやすく説明していきますので、ぜひご覧ください。
☆ 冷却曲線とは
冷却曲線とは、物体が液体から固体に凝固するときの温度変化を表したグラフとなっています。
皆さん、物質の三態の分野でこのようなグラフを見たことがあると思います。

純物質を冷却して、気体から液体、液体から固体に状態変化するときの温度変化を表したグラフです。
固体と液体が共存しているときや液体と気体が共存しているときに温度変化がないのは、状態変化にエネルギーを全て使ってしまうから、ってやつです。
このようなよく見るグラフの、液体が固体に凝固するまでの温度変化を切り取ったのが冷却曲線です。

ちなみに上の図っていうのは、純物質における冷却曲線となっています。
入試によく出る、凝固点降下とからめた冷却曲線は下のようになります。

これが純物質(溶媒)に何かが溶けた希薄溶液の冷却曲線となっています。
純物質(溶媒のみ)の冷却曲線と希薄溶液の冷却曲線の何が違うのかに注目しながら、冷却曲線について詳しく読み取っていきたいと思います。
☆ 純溶媒と希薄溶液の冷却曲線の違い
純溶媒と希薄溶液の冷却曲線の違いは2つあります。
① 過冷却と呼ばれるグラフが凹んでいる部分がみられる。
② グラフのx軸の最後の方が右肩下がりである。
の2つです。

それぞれ紐解いていこうと思います。
☆ 過冷却とは
グラフの凹んでいるところは、希薄溶液が過冷却となった状態です。
過冷却とは、凝固点になっているのに状態変化が起こらず、温度が下がり続ける現象のことをいいます。
過冷却が起こるメカニズムは、大学入試では問われることはありません。
一応興味がある人向けに説明しておくと、
物質が凝固するためには、中心となる「核」が必要です。
核の周りを取り囲んでいくように、物質というのは凝固が起こっていくのです。
希薄溶液の場合、溶質粒子が邪魔をするため、「核」ができづらくなっています。
核がなかなかできない結果として、凝固点以下になっても状態変化(凝固)が起きない過冷却状態となるのです。

あくまでも溶質粒子が核を作るのを邪魔することによって過冷却は起こるので、邪魔する粒子がない純溶媒の冷却曲線では過冷却は見られません。
また、下の図でいう直線deの延長線と、曲線acの交点であるbの温度が希薄溶液の凝固点となりますので確認しておきましょう。

ベースは純溶媒の冷却曲線と同じだと思えば、がっつりの暗記でなくても答えることができそうですね。
☆ 希薄溶液の冷却曲線の最後が右肩下がりのわけ

上のグラフの囲んだ部分のように、希薄溶液の冷却曲線は最終的に右肩下がりになります。
その理由を入試問題で記述として問われやすいので、しっかり確認しましょう。
先に結論をいうと
冷却曲線の液体と固体が共存している部分が右肩下がりになる理由は、溶媒に対する溶質粒子の濃度が増加し、凝固点降下が進行するためです。
物質が凝固するとき、固まるのは溶媒であって、溶質は凝固しません。
なので、溶液を冷やせば冷やすほど、溶媒のみが凝固し、溶質は溶液に溶けたままになります。

溶媒は凝固によって溶液にある粒子数が減少するのに、溶質の溶液中の粒子の数は変化しません。
すると、相対的に溶媒に対する溶質粒子の数が増えていくため、凝固点降下が起こり、冷却すればするほどグラフは右肩下がりになっていくのです。
(凝固を邪魔する溶質粒子の数が多いほど、凝固点降下も大きくなります。凝固点降下の記事はこちら。)
【高校化学】凝固点降下の原理をわかりやすく徹底解説!なんで電解質の方が方が凝固点が下がりやすいの? - 化学の偏差値が10アップするブログ
☆ まとめ
希薄溶液の冷却曲線には、純溶媒の冷却曲線と違って過冷却がある。
希薄溶液の冷却曲線の最後が右肩下がりなのは
溶媒だけが凝固し、溶媒に対する溶質の量が増加し、凝固点降下が起こったため。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】蒸気圧降下と沸点上昇の原理をわかりやすく徹底解説!電解質と非電解質との違いは?

沸点上昇の計算問題、原理はよくわからないけど、とりあえず公式を丸暗記して乗り切ってる方は多いのではないでしょうか。
電解質のときは、電解して生成したイオンの分子の数だけ掛け算しているけど、それを行う意味をわかっていない方も多いと思います。
今回は蒸気圧降下と沸点上昇の原理について、徹底解説していきたいと思います。
原理から公式の意味をしっかり理解して、ライバルと差を付けちゃいましょう。
☆ 蒸気圧降下と沸点上昇とは
蒸気圧降下とは、純溶媒よりも希薄溶液の方が蒸気圧が小さくなる現象のことをいいます。
何も溶けていない溶液よりも、何かが溶けている溶液の方が蒸気圧が小さくなるわけです。
沸点上昇とは、蒸気圧降下が起こった結果、沸点が上昇する現象をいいます。
イメージとしては、蒸気圧降下が起こった結果として、たまたま沸点が下がる現象が確認された、という感じです。
なので、沸点上昇と蒸気圧降下はお互いを理解する上で切り離して説明することができないものとなっています。
よくこの2つの現象を別々に切り離して理解しようとする方がいますが、原理を考える上では、この2つはセットで扱うようにしましょう。
どちらも希薄溶液の代表的な性質の1種です。
※ 希薄溶液とは、濃度が薄い溶液のことです。
☆ 蒸気圧降下の原理
なぜ、純粋な溶媒(純溶媒)よりも希薄溶液の方が蒸気圧が小さくなるのかをみていこうと思います。
蒸気圧とは、気液平衡の状態(気体と液体)における、気体の圧力のことを言いました。
例えば、ペットボトルに入っている水は液体のみで存在しているわけじゃなく、一部は水蒸気(気体)の状態として存在しています。
このときの水蒸気の圧力が蒸気圧です。
純溶媒では、液体の表面にある溶媒粒子が熱運動によって気相に飛び出して、気体となっています。
気体となっている溶媒分子による圧力が、蒸気圧です。
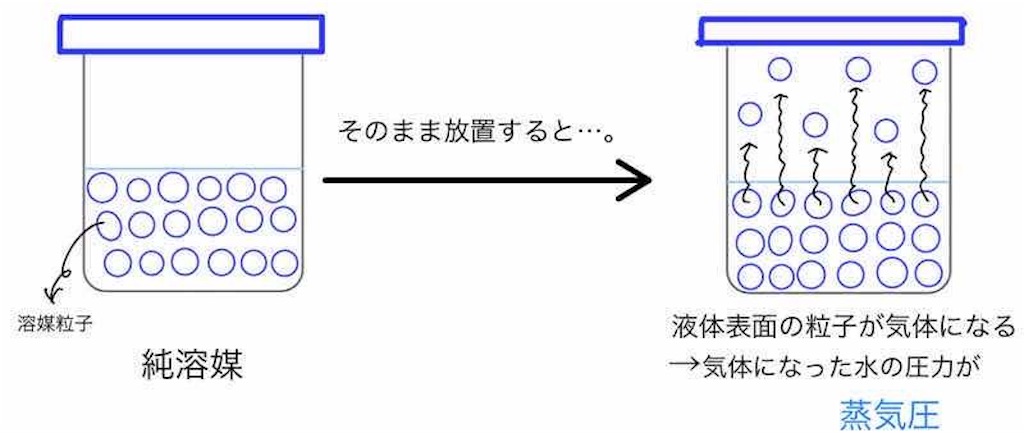
純溶媒に溶質を溶かして希薄溶液とすると、蒸気圧はどうなるでしょうか。
当然ですが、溶質が溶けている分、液体の表面にある溶媒分子の数は減少します。

その分、気相に飛び出す溶媒分子の数も減少するので、蒸気圧は減少しますね。

これが蒸気圧降下です。
つまり、蒸気圧降下とは、溶質粒子に邪魔されることによって、気相に飛び出す溶媒分子が減った結果
蒸気圧が小さくなる現象をいいます。
溶媒に対する溶質粒子の数が多ければ多いほど、その分気相に飛び出す溶媒粒子が減少するので
蒸気圧は小さくなります。
☆ 沸点上昇の原理
蒸気圧が降下をすると沸点は上昇します。
状態図を見てみましょう。

上の図のように、圧力と温度における物質の状態を表した図を状態図といいます。
状態図の液体と気体の境界線部分をピックアップしたものが、蒸気圧曲線です。
純溶媒に溶質を入れて、蒸気圧降下が起こったら、蒸気圧曲線はどのようになるでしょうか。

蒸気圧曲線が下にずれ込むのがわかりますね。
沸点というのは、標準状態(1.0×105 Pa)における蒸気圧曲線との交点の温度をいいます。
蒸気圧曲線が下にずれると、沸点は上昇します。


蒸気圧降下が起こり、蒸気圧曲線が下にずれた結果、沸点がグラフ上で上昇する現象が沸点上昇です。
沸点上昇は蒸気圧曲線がないと説明できないものとなっていますので、グラフとセットで頭に入れておきましょう。
☆ 沸点上昇の公式
蒸気圧降下がおこった結果、蒸気圧のグラフが下にずれて、沸点が上昇するのは理解できたと思います。
つまり、蒸気圧降下が大きければ大きいほど、沸点上昇度も大きくなるわけです。
そして、溶媒に対する溶質粒子の割合(邪魔をする粒子の割合)が大きいほど、蒸気圧降下も大きくなります。
溶媒に対する溶質粒子の割合が大きいほど、沸点上昇も大きくなるわけです。
よって、沸点上昇を求める公式は次のようになっています。

質量モル濃度mは、溶媒(kg)に対する溶質のmolを表したものです。
溶媒に対して、どれだけ溶質粒子(=蒸気圧になるのを邪魔する粒子)があるのかを表しています。
この公式は、溶媒に対する溶質粒子の数(=蒸気圧になるのを邪魔する粒子)と沸点上昇は比例の関係であるという意味となっています。
kは比例定数で、kは溶媒によって固定の値をとります。
☆ 沸点上昇と電解質
電解質は溶媒に溶けると電離して、イオンになる物質です。
例えば、塩化ナトリウムや硫酸ナトリウムがイオン性の電解質です。

硫酸ナトリウムは水に溶けると、1分子から3分子分のイオンに電離していて
塩化ナトリウムは水に溶けると、1分子から2分子分のイオンに電離するわけですね。

しつこいようですが、
邪魔する溶質粒子の数が多いほど、沸点上昇度は高くなります。
電解質の場合、電離して生成したイオンの分子の数だけ、邪魔する粒子が増えるのですから、
沸点上昇の公式に、生成したイオンの分子の数だけ掛け算する必要があります。

☆ まとめ
蒸気圧降下とは
溶質粒子によって溶媒粒子が蒸気圧になるのを邪魔されて、蒸気圧が小さくなる現象
沸点上昇とは
蒸気圧降下がおこった結果、蒸気圧曲線が下にずれて、沸点が上昇する現象
である。
沸点上昇の公式は

電解質の場合は、電離して生成したイオンの数だけ、公式に掛け算をしなくてはいけない。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】浸透圧とは?簡単に簡単にわかりやすく説明!公式の導き方と計算問題の注意点

浸透圧の原理をいまいち理解せずに、公式だけ丸暗記している方も多いですよね。
なんとなく計算はできるけど、公式に代入する以外の問題になると対応ができない方も多いと思います。
今回は、浸透圧の原理とファントホッフの浸透圧の公式の導き方、よくある間違えなどを徹底解説していきたいと思います。
3つ目の希薄溶液の性質となっております。凝固点降下や沸点上昇と合わせて確認しておきましょう。
☆ 浸透とは
浸透圧とは何なのかを理解する前に、浸透という現象について理解しましょう。
高校化学における浸透とは、濃度の薄い方から濃い方へと溶媒が移動する現象のことをいいます。
教科書などでよく用いられる図をみながら原理を説明していきたいと思います。

このように半透膜を使って、U字管を半分に区切ります。
半透膜の右側には純粋な水(溶媒のみ)をいれ、半透膜の左側には溶液(何かが溶けている状態)を入れます。
これをしばらく放置するとどうなるでしょうか。
まず、押さえておかないといけないポイントとしては、半透膜とは何かということです。
半透膜とは、特定の粒子のみを通すことができる膜のことをいいます。
浸透圧における半透膜は、溶媒粒子は通すことができるけど、溶質粒子は通すことができない膜となっています。
半透膜には粒子レベルの細かい穴が開いていて、粒子の大きさによって半透膜を通過できるものを選別しています。
※ダニエル電池のところでも、半透膜については触れています。
【高校化学】ダニエル電池の原理を徹底解説!ボルタ電池との違いや素焼き板の意味は? - 化学の偏差値が10アップするブログ
U字管の半透膜部分を拡大してみてみましょう。

半透膜の穴は、溶媒粒子のように小さい粒子は通過できるけど、溶質粒子のように大きい粒子は通過することができません。
その結果、例えばの話にはなりますが、図の状態だと
純溶媒から溶液(左から右)には、溶媒粒子は5粒分、半透膜を通過することができるが
溶液から純溶媒(右から左)には、溶質粒子に移動を邪魔されるため、溶媒粒子は2粒分しか通過できない
ということが起こります。

純溶媒から溶液へは、5粒分の溶媒粒子が移動している
溶液から純溶媒へは、2粒分の溶媒粒子が移動している
ということは、相対的に3粒分の溶媒粒子が純溶媒から溶液へと移動しているわけです。

溶媒粒子の移動は、純溶媒⇄溶液へと双方間でおこっています。
ただ、溶液から純溶媒へと移動する溶媒粒子の個数は、溶質粒子に邪魔をされてしまうため、純溶媒から溶液へと移動する溶媒粒子の個数より少なくなります。
相対的に見ると、濃度が薄い方(純溶媒)から濃度が濃い方(溶液)へと溶媒粒子が移動しているように見えます。
この現象が浸透です。
☆ 浸透圧とは
先ほどのU字管に戻りたいと思います。

このように、先ほどのU字管を放置しておくと、純溶媒から溶液へと溶媒粒子が移動していくので溶液側の液面が上昇します。
浸透圧の定義は実は2つあり、
1つ目は、単純に純溶媒から溶液へと溶媒粒子が流れるこむときの圧力のことをいいます。
2つ目は、溶液側の液面が上がらないように無理やり押さえつけたときの圧力をいいます。

なので、普通に浸透をするときの圧だけではなく
上記の図のように、液面差が出ないように無理やり溶液側から押さえつけたときの力も浸透圧です。
2つの定義はしっかり頭に入れておきましょう。
☆ 浸透圧の公式の導き方
先に結論を言うと、浸透圧を求める公式のことをファントホッフの式といい、
公式自体は次のようになっています。

ファントホッフの公式を導いてみたいと思います。
まず、浸透圧と単位体積あたりの粒子の個数(=濃度)は比例の関係にあります。
なぜかというと、純溶媒との濃度の差が大きければ大きいほど、溶液から純溶媒側に移動する粒子の個数は少なくなり
(濃度が濃いということは、邪魔をする溶質粒子が多いということ)
相対的な溶媒粒子の移動する数(=浸透)が大きくなるからです。
また、浸透圧と温度も比例関係にあります。
こちらは単純に温度が上がると熱運動が激しくなり、粒子間の移動も激しくなるからです。
これらのことから、ファントホッフの公式が導かれるわけです。

(※ 魚みたいな記号は比例を表す記号です。)
先程言ったように、純溶媒と溶液の濃度差が大きいほど、浸透圧も大きくなるのでした。これは邪魔する溶質粒子の数が増えるからです。
よって、電解質(イオン性の物質)の場合は、ただ公式に代入するだけではなく、電離した後の粒子の個数を公式のnの部分にかけてあげる必要があります。
電離した分だけ、邪魔をする溶質が増えるのだから当たり前ですね。
ただ、電解質の場合は電離後の粒子の個数でかけてあげるというのを忘れがちな人が多いので、注意してください。
ちなみに、比例定数Rが気体の状態方程式と同じになる理由は、入試問題で問われないので知る必要はありません。
状態方程式と浸透圧の定数が同じになることを発見した人が昔、ノーベル科学賞をもらったくらい難しい話になってきますので
ここでは割愛したいと思います。
☆ 公式以外のよくある計算問題
U字管に戻ります。
浸透は永遠に起こるわけではなく、ある一定の濃度になったとき終わりを迎えます。
純溶媒が全て溶液側に移動するまで浸透がおこるわけではありません。

浸透が終わる、つまり、状態が変化しないということは(物質が動かないということは)
浸透圧と何か他の力がつり合っているということ。
浸透圧とつり合っている力はなにでしょうか。
浸透圧とつり合っている力は、上昇した溶液分の重力です。

浸透圧と、上の図のピンクで囲った部分の重さが一致したとき、浸透の現象がなくなるのです。
なので、浸透圧というのはファントホッフの式だけではなく、このように書き換える事もできます。

上の関係性を用いた計算問題として、水銀柱が絡んだものが入試でよく出題されます。
セミナーや問題集などにその手の問題が載っているはずなので、これらの関係性を意識しながら問題を解いてみて欲しいなと思います。
☆ 最後に
浸透とは
相対的に見て、濃度が薄い方(純溶媒)から濃度が濃い方(溶液)へと溶媒粒子が移動する現象。
浸透は、溶質粒子が溶液から純溶媒へと溶媒粒子が移動しようとするのを邪魔することによって起こる。

化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】凝固点降下の原理をわかりやすく徹底解説!なんで電解質の方が凝固点が下がりやすいの?

凝固点降下の原理はわからないけど、とりあえず公式を丸暗記する受験生の方は多いはず。
原理がわかっていないと、公式以外の問題が出てきたとき、対応するのは難しいですよね。
今回は凝固点降下の原理を、公式の導き方を踏まえて徹底解説していきたいと思います。
公式を丸暗記するのではなく、考えて式を作れるようになりますよ。
☆ 凝固点降下とは
凝固点降下とは、純粋な溶媒よりも希薄溶液の方が凝固点が低くなる現象のことをいいます。
なんだか定義を聞くと難しいような感じがしますが、要は
何も溶けていない溶媒よりも、何かが溶けている溶液の方が凝固点が低くなってしまう、ということです。
水よりも食塩水の方が凝固点は低くなるのですね。

ちなみに、凝固点降下は希薄溶液の性質の1種です。
希薄溶液とは、濃度が薄い溶液という認識で大丈夫です。
希薄溶液の性質は大きく分けて、
① 蒸気圧降下/沸点上昇 ② 凝固点降下 ③ 浸透圧
の3つがあります。
これらの3つは共通テストで、正誤判定問題として同時に出題されることがとても多いので、まとめて勉強するのがおすすめです。
沸点上昇、浸透圧の記事はこちら
(後日アップ予定!)
☆ 凝固点降下の原理
・ 純粋な溶媒のみの凝固点
何も溶けていない純溶媒の場合、凝固点は溶媒そのものの固定の値に由来します。
また、押さえておきたいポイントとしては、純溶媒が凝固する過程において
融解が起こる速度=凝固が起こる速度
が成立しているということ。
つまり、溶けるスピードと固まるスピードが一致しているわけですね。

このように、溶けるスピード(融解)と固まるスピード(凝固)が同じなので、一見何も起こってないように見える現象のことを溶解平衡といいます。
純溶媒のみの場合、溶解平衡の状態に物質はあります。
・ 希薄溶液の場合
次に、溶媒に何かが溶けている場合、すなわち希薄溶液の場合の凝固点を確認していきたいと思います。
もう一度、純溶媒のみの凝固点の様子をみてみましょう。

溶媒しかないので、凝固を邪魔するもの(=阻害するもの)がありません。
その結果、溶解平衡が起こっているのでしたね。
では、溶質が溶けている状態の希薄溶液はどうでしょうか。
当然ですが、溶質が溶けてる分、凝固する結晶の周りは純溶媒のみのときよりも、溶媒粒子に対する溶質粒子の割合が大きくなります。
すると、溶媒粒子が凝固するのを溶質粒子に邪魔されてしまうので、凝固する溶媒粒子の数が少なくなります。

その結果、融解が起こるスピード>>>凝固が起こるスピードとなり
溶解平衡の状態が崩れ、凝固する温度が純溶媒のみのときより低くなります。
溶質粒子に溶媒粒子が凝固するのを邪魔されることによって、凝固点が下がる現象、これが凝固点降下となっています。
☆ 凝固点降下の公式
先に結論から言ってしまうと、凝固点降下の公式は次のようになっています。

公式に出てくるmは質量モル濃度といって、溶媒粒子の質量(kg)に対する溶質粒子の個数を表したものになっています。
凝固点降下は、溶媒が凝固するのを溶質粒子に邪魔されるから起こるのでした。
つまり、溶媒に対する溶質粒子の数がたくさんあればあるほど、溶媒の凝固は起こりづらくなりますよね。
凝固点降下の公式は、溶媒を邪魔する溶質粒子の個数(=質量モル濃度m)と凝固点降下は比例の関係にあるというのを表したものです。
モル凝固点降下Kは比例定数で、溶媒ごとに固有の値をとります。
(モル凝固点降下が溶媒ごとに特定の定数だと知らない人が割と多いです。そのことを理解しているかどうかを判断する入試問題は多いので、しっかり押さえましょう。)
溶液中の溶質粒子(凝固を邪魔する粒子の個数)に比例して凝固点が下がるのだから、同じモル濃度であっても
電離してイオンの状態になっている電解質の方が凝固点降下の割合は大きいことがわかります。
☆ 凝固点降下の例題
最後に共通テストや私立の入試問題で良く出題される練習問題を解いて終わりにしたいと思います。
(例題)純粋な水に1kgに、濃度が同じア〜エの物質を違うビーカーでそれぞれ溶かした。この中で最も凝固点が低くなるもの、ア〜エの記号で答えなさい。
ア グルコース イ 硫酸ナトリウム ウ 塩化ナトリウム エ 尿素
(答え)
イ 硫酸ナトリウム
(解説)
凝固点降下は溶液となったあとの溶質粒子の数が多ければ多いほど、大きくなります。
この問題の場合、溶質の溶液となる前のモル濃度は全て同じです。
溶媒の量も全て同じ。
ということは、溶液となった後の溶質粒子の数が多いものが、溶媒に対する溶質粒子の数が多くなり、凝固点も低くなりますね。
1分子を溶かしたら、溶かした後も電離しないので1分子です。
イの硫酸ナトリウムとウの塩化ナトリウムは電解質です。
なので、電離した後の粒子の個数を確認してみます。

電離のイオン反応式はそれぞれ上記のようになっています。
硫酸ナトリウムは、硫酸ナトリウム1分子から合計3分子のイオンが
塩化ナトリウムは、塩化ナトリウム1分子から合計2分子のイオンが
生成しているのがわかりますね。

よって、溶液となった後の溶質粒子が1番多いのはイの硫酸ナトリウムです。
凝固を邪魔する溶質粒子も1番多いので、凝固点が最も低くなります。
☆ まとめ
凝固点降下は、
溶媒粒子が凝固をするのを、溶質粒子が邪魔をすることによって起こる。
凝固点降下は溶媒に対する溶質粒子の割合(=質量モル濃度)と比例するので、公式は次のようになる。

化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
過冷却曲線についての記事はこちら
(後日アップします。)
【高校化学】水酸化ナトリウムは電気分解からできている!工業的製法である陽イオン交換膜法の原理を徹底解説

強塩基として馴染みがあり、高校化学においてよく見かける化合物の一種です。
水酸化ナトリウムは石鹸を作るのに利用されていたりして、日常生活においても、受験化学においても、水酸化ナトリウムの工業的製法は大切な役割を持っています。
今回は、そんな超重要物質である水酸化ナトリウムの製法である「陽イオン交換膜法」について原理から徹底解説していきたいと思います。
陽イオン交換膜法は論述問題を問われることが多い分野です。
しっかりと理屈を踏まえて理解できるようにしましょう。
☆ 陽イオン交換膜法とは
電気分解を用いた、水酸化ナトリウムNaOHの工業的製法です。
「陽イオン交換膜法といえば?」「水酸化ナトリウムの工業的製法!」って、すぐに答えられるようにしましょう。
こういう単純な問題が、よく入試に出題されます。
陽イオン交換膜法は
電極:陽極 炭素C 陰極 鉄Fe
電解液:陽イオン交換膜で仕切られていて、陽極側 NaCl水溶液 陰極側 水に薄い水酸化ナトリウムを溶かしたもの
で電気分解する方法となっています。

つまり、塩化ナトリウムの電気分解から水酸化ナトリウムは生成しているわけです。
陽イオン交換膜で電解液が仕切られていること、交換膜の片方にしか塩化ナトリウムを入れていないことがポイントです。
各極のイオン反応式であったり
陽イオン交換膜の役割や、そもそも陽イオン交換膜とはなんなのか
これらのことが入試で聞かれやすいので、1つ1つ確認していきたいと思います。
☆ 陽イオン交換膜とは
陽イオン交換膜は、陽イオンしか通すことのできない半透膜のことをいいます。
半透膜というのは、特定の粒子しか通すことのできない膜のことをいいましたね。
半透膜の反対側に粒子が移動するには、移動を手助けするための原動力がなくてはいけません。
詳しくはダニエル電池の分野で、半透膜について詳しく解説しているのでそちらをご覧ください。
【高校化学】ダニエル電池の原理を徹底解説!ボルタ電池との違いや素焼き板の意味は? - 化学の偏差値が10アップするブログ
では、どうして陽イオン交換膜は陽イオンのみを通すことができるのか。その原動力は何なのでしょうか。
陽イオン交換膜は、マイナスの電荷でコーティングされています。

プラスの電荷を持っている同士や、マイナスの電荷を持っているもの同士は反発する
プラスとマイナスの意符号の電荷を持っているものは引きつけ合います。
よって、プラスの電荷を持つ陽イオンが、陽イオン交換膜を通過しようとすると、反発してしまうので通過できない
マイナスの電荷を持つ陰イオンはプラスに引きつけれて、交換膜を通過できる
ということになります。

☆ 陽イオン交換膜法の原理
・ 各極での反応
陽イオン交換膜法はあくまでも、塩化ナトリウムの電気分解です。
電気分解ということで、各極のイオン反応式を作っていきたいと思います。
【高校化学】電気分解の各極のイオン反応式の作り方やルールを徹底解説!フローチャート通りにやれば簡単に作れる - 化学の偏差値が10アップするブログ
↑電気分解のイオン反応式の作り方はこちら

こちらの画像を見ながら確認していきます。
(陽極)
陽極では電子を放出する酸化反応が起きるのでした。
各極の反応式の作り方に従ってみていくと
① 電極をみる
炭素なので安定 → 変化なし
② 電解液をみる
塩素化物イオンCl−(ハロゲン化物イオン)あり
→ ハロゲンの単体が生成

(陰極)
陰極では電子を受け取る反応が起きています。
電極自身は電子を受け取る能力はないので、最初から電解液を確認するのでしたね。
① 電解液をみる
水素よりもイオン化傾向が小さいものはなし
→ 水の電気分解、水素が発生

各極の反応を図示すると下のようになります。
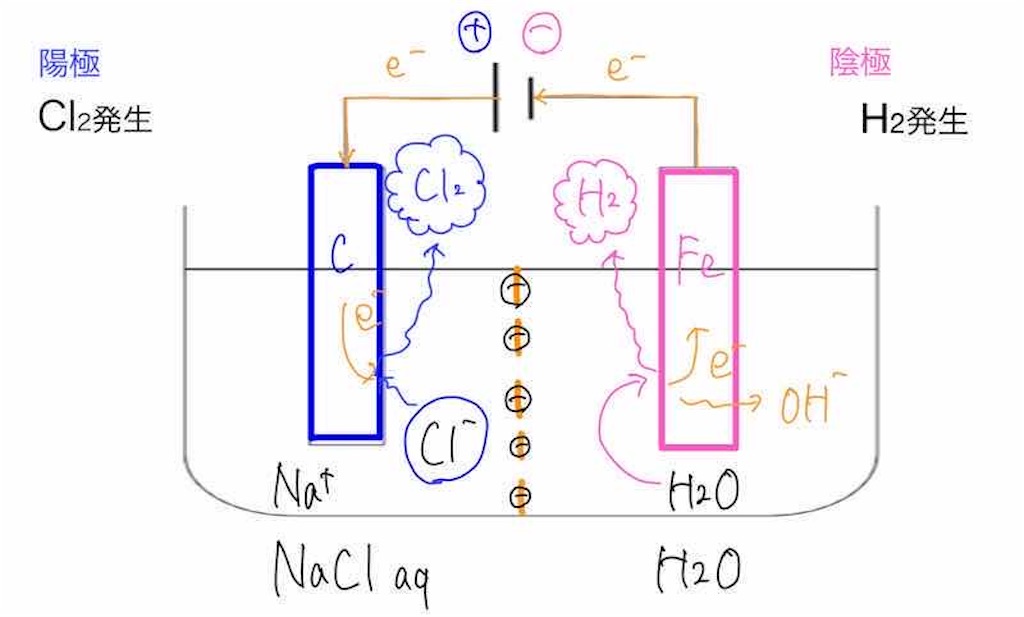
・ 陽イオン交換膜を移動するイオン
ここで、陽イオン交換膜を通過するイオンを確認していきましょう。
半透膜についてしっかり理解している人は、暗記ではなく考えて導くことができると思います。
電気分解中の電解液では、先ほど確認した通り
陽極側では、塩化物イオンが消費されて、塩素分子が発生
陰極側では、水が電子を受け取って、水素と水酸化物イオンが発生
しています。
つまり、
陽極側は塩化物イオンが消費されたけど、ナトリウムイオンNa+はそのまま残っている
すなわち、プラスの電荷が多くなっている状態である
陰極側は水酸化物イオンが生成した分、マイナスの電荷が多くなっています。
電解液の電荷の総和に偏りがあるとき、電荷が打ち消される方向にイオンの移動が起きます。
ただ、今回は陽イオン交換膜によって仕切られているので、マイナスの電荷を持つ陰イオンは半透膜を通過できません。
よって、陽極側のナトリウムイオンが陽イオン交換膜を通って、陰極側へと移動するような反応が起きます。

すると、
陰極側には、水酸化物イオンとナトリウムイオンが同時に存在することになりますね。
つまり、水酸化ナトリウムが陰極側で生成するわけです。
電気分解をすればするほど、陰極側の水酸化ナトリウムの濃度は濃くなっていきます。
これを取り出すことによって水酸化ナトリウムを得ているのが、陽イオン交換膜法です。
☆ おまけ、陰極側に水酸化ナトリウムを少しだけ溶かす理由
陰極側は純粋な水ではなく、少しだけ水酸化ナトリウムを溶かしておきます。
なぜ、水酸化ナトリウムを溶かす必要があるのでしょうか。
純粋な水はほぼ電離しておらず、純粋な水のみだと電気を通せなくなるからです。
(厳密にいうと電気は通るが、大量生産する工業的製法には水の電離程度の電気の流れでは効率が悪いです。)
電気が流れるのは、電離しているイオンが電気を運んでくれるから。
水というのは、水の電離平衡でも学習したように

程度しか電離しておらず、電離度はとても小さいんでしたよね。
純水はあまりにも電離度が小さすぎて、なかなか電気分解によって電気を通すことができない、
生産性を上げるためにも、より電気が通るように純水ではなく、純水に水酸化ナトリウムを微量とかしたもので電気分解が行われています。
だから、陽イオン交換膜はゼロから水酸化ナトリウム作るというよりかは
陰極側の水酸化ナトリウムを濃いものにしていくイメージです。
☆ まとめ
陽イオン交換膜法とは
陽イオン交換膜で電解液を仕切って、塩化ナトリウムを電気分解することによって、水酸化ナトリウムを生成する反応である。
各極では

の反応が起こっている。
陽イオン交換膜はマイナスの電荷を帯びているので、陽イオンしか通すことができない。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。
【高校化学】アルミニウムの工業的製法である融解塩電解(溶融塩電解)の原理をわかりやすく解説!普通の電気分解と違うの?

アルミニウムの工業的製法である融解塩電解。
普通の電気分解と何が違うのかが曖昧な受験生の方も多いですよね。
アルミニウムの融解塩電解は丸暗記では入試問題には対応できず、原理をしっかりと理解しておく必要があります。
今回はアルミニウムの工業的製法である融解塩電解の原理と、普通の電気分解の違いについて徹底解説していきたいと思います。
論述問題で聞かれがちなところでもありますので、確実に理解しておきましょう。
☆ アルミニウムの工業的製法
アルミニウムは自然界において、ボーキサイトという鉱山中に多く含まれている物質として存在しています。
ボーキサイトというのは主成分が酸化アルミニウムAl2O3、不純物としてFe2O3が含まれている物質となっています。
ボーキサイトから純粋なアルミニウムを得る手順は大きく分けて2ステップです。
① ボーキサイトから不純物Fe2O3を取り除いて、純粋なAl2O3(これをアルミナといいます。)を得る
② アルミナを溶解塩電解して、純粋なアルミニウムを得る(これがメイン!)
になります。
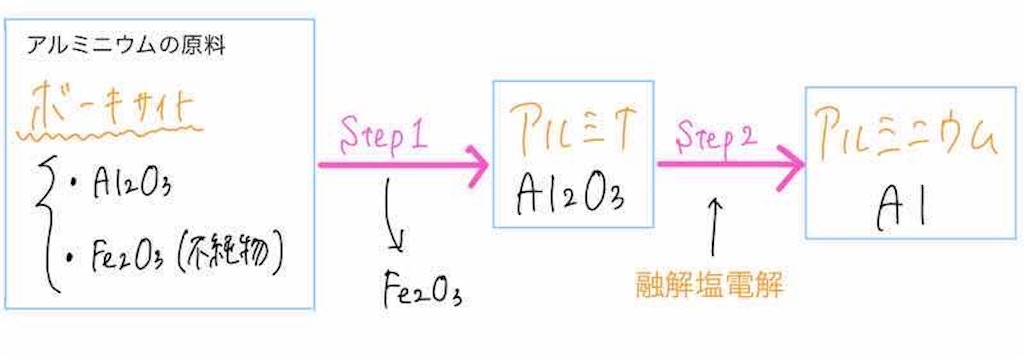
ステップ①、②と2段階に分けて説明していきたいと思います。
☆ ステップ① ボーキサイトから不純物を取り除いて、純粋なアルミナを得る
ボーキサイトからアルミナをとる方法のことをバイヤー法といいます。
ボーキサイト、アルミナ、バイヤー法の3つの単語はよく穴埋め問題で出題されますので、覚えておきましょう。
バイヤー法のざっくりとした流れは
アルミニウムだけを溶かして、ろ過! …(1)
溶けているアルミニウムを、固体(アルミナAl2O3)に戻す! …(2)
です。

細くみていきましょう。
(1)アルミニウムだけを溶かす方法
アルミニウムだけを溶かして、不純物は固体のままだったら、ろ過をすればアルミニウムと不純物とを分けることができます。
ここで思い出してほしいのは、アルミニウムは両性元素だということ。
両性元素の単体あるいは酸化物は、酸にも塩基にも溶けるという性質を持っています。
(ついでにいうと、両性元素以外の金属も酸には溶けますが、塩基には溶けません。塩基に溶けるのは両性元素の特権です。)
なので、強塩基である水酸化ナトリウムNaOHをボーキサイトに入れれば、
メインのアルミニウムは溶けて、不純物(Fe2O3)は溶けません。
ろ液にあるアルミニウムだけを不純物と分離することができます。
(2)融解塩電解をするために固体に戻す
この後の電気分解の電解液にするために、アルミニウムを固体に戻す作業をします。
ろ液を水で薄めると、ろ液中にあったアルミニウムの錯イオンは、水酸化アルミニウムになります。

水で薄めると水酸化物イオンの濃度が下がります。
すると、ルシャトリエの法則で水酸化物イオンの濃度が増える方向へと反応が進むので、水酸化アルミニウムが生成するのですね。
最後に、この水酸化アルミニウムを

加熱して上記の反応を起こし、純粋なアルミナAl2O3を生成します。
☆ ステップ② 溶解塩電解
・そもそも溶解塩電解とは
やっとメインの溶解塩電解に入っていきます。
その前に溶解塩電解とは何なのかを確認しておきましょう。
溶解塩電解は電解液に水がない状態で電気分解する方法であり、
イオン化傾向が水素より小さい金属の単体を生成するときに使います。
大切なのでもう一度言います。
電解液に水がないのです。
電解液は金属などの固体を溶かして液体にしたものを用います。
(だから、溶解、塩電解というんですね。金属を溶解した電解液を使うから。)
・アルミニウムの溶解塩電解の基本的な装置
アルミニウムの溶解塩電解をみていきたいと思います。
電気分解の知識を忘れてしまった方は、こちらのページで確認してください。
【高校化学】電気分解の各極のイオン反応式の作り方やルールを徹底解説!フローチャート通りにやれば簡単に作れる - 化学の偏差値が10アップするブログ
アルミニウムの溶解塩電解は、
電極:陽極陰極どちらも炭素、 電解液:アルミナと氷晶石を溶かしたもの
で行います。

(しつこいですが、水はないです。強調するためにバッテンを水につけました。)
ちなみに氷晶石の役割はとても大切です。入試問題に何度論述で出題されたことでしょうか、笑
氷晶石の化学式はNa2AlF6です。
そして、先ほども言ったように、溶解塩電解の電解液は金属を溶かしたものでなくてはいけません。
つまり、この場合はアルミナを溶かさないといけません。
アルミナの融点は2000度でめっちゃ高いです。これを溶かすのってとても大変。
ここで出てくるのが氷晶石で、凝固点降下剤として使用します。
氷晶石って電離すると

こうなります。氷晶石1分子から9分子分のイオンが発生するのです。
凝固点降下は溶媒に対する溶質粒子の数が多いほど、大きくなるのでしたね。
氷晶石由来の9つ分のイオンによって、アルミナの融点は960度ほどまで下がります。
氷晶石のおかげで、アルミナを溶かすことができるのです。
・アルミニウムの溶解塩電解の原理
では、基本的な電気分解のルールに則って、各極のイオン反応式を作っていきたいと思います。

(陽極)
電子を放出する反応が起きます。
① 電極をみる
炭素なので安定 → 反応なし
② 電解液をみる
ハロゲンなし → 水の電気分解によって酸素発生
→ 水もない!
いつも通り手順に従って、陽極のイオン反応式を作ろうとしましたが、溶解塩電解では水がないので酸素が発生できません。
なので、最終手段として安定な炭素電極が二酸化炭素となって溶け出すような反応が起きます。

水がないからこそ起きる特殊な反応ですね。
考えてわかる反応式ではないですので、しっかりと暗記してください。
(陰極)
電子を受け取る反応が起きます。
① 電解液をみる
イオン化傾向が水素より小さい金属のイオンなし → 水の電気分解によって水素発生
→ 水もない!
陽極と同じように、ルールに従ってイオン反応式を作りましたが、こちらも水が存在しません。
なので、水素が発生できない。では、どういう反応が起きるのかというと

最終手段として、電解液中のアルミニウムイオンが電子を受け取って、アルミニウムの単体になります。
普通の電気分解では水があるので、イオン化傾向が水素より小さい元素は単体として析出できません。
溶解塩電解で水をなくすことによって、普段は析出することのないイオン化傾向が水素より小さい元素の析出を可能にするのです。
個人的には良く練られた面白いシステムだなと思います。
普段は析出することない金属単体を生成することができるので、溶解塩電解はイオン化傾向が小さいナトリウムの生成にも使われています。
(ナトリウムは水と爆発的に反応しちゃうし、水を使わない溶解塩電解は大きなメリットがありますね。)
☆ まとめ
アルミニウムは溶解塩電解という、水を使わない電気分解によって生成している。
水がないからこそ

の反応が起こる。
溶解塩電解は普通の電気分解では生成しない、イオン化傾向が小さな金属の単体を析出するのに適した方法である。
また、氷晶石の役割は、
アルミナの融点を下げるため、アルミナの凝固点降下を促進するため
である。
化学の偏差値10アップを目指して、頑張りましょう。
またぜひ、当ブログにお越しください。